哮*是一种异质性疾病,以气道高反应性、气道炎症和可逆性气道重塑为特征。作为一种慢性呼吸道疾病,哮*影响着 3.58 亿人,尤其是儿童。哮*患者表现为呼吸困难、*息、**和/或胸闷等呼吸道症状。这些症状在病情较严重时频率和强度增加,并伴有呼气气流限制和肺功能全面下降。
哮*发病机制研究新进展
尽管病毒、细菌、环境毒素、臭氧和过敏原被认为是导致哮*疾病急性加重和进行性恶化的原因,但导致急性加重的确切触发因素和潜在分子机制仍不清楚。确定疾病恶化的触发因素、暴露于此类触发因素的分子后果,以及防止对此类触发因素过度反应的治疗干预方式,可能对改善哮*患者治疗效果提供帮助。
1. 细颗粒物通过细胞外囊泡包装的 Let-7i-5p 介导MAPK 信号通路诱导哮*发作
直径小于 2.5 微米的细颗粒物 (PM2.5) 是儿童急性哮*发作的主要危险因素。南京医科大学公共卫生学院Zhengdong Zhang团队发现PM2.5 处理的人支气管上皮( HBE) 细胞分泌的细胞外囊泡 (PM2.5-EVs) 可对“水平” HBE 细胞中引起细胞毒性,并增加“纵向”敏感的人支气管平滑肌细胞 (HBSMC) 的收缩性[1]。RNA 测序显示 let-7i-5p 在 PM2.5-EVs 和哮*患者血浆中过表达;此外,其水平与哮*儿童的 PM2.5 暴露量相关。机制上,let-7i-5p 通过与 ELAVL1 相互作用被包装到 PM2.5-EV 中,并被“水平”受体 HBE 细胞和“纵向”受体敏感 HBSMC 内化,随后通过抑制DUSP1激活 MAPK 信号通路(图1)。这一研究结果揭示了 EVs 包装的 miRNA 调节的细胞间通讯诱导哮*的关键机制,为哮*的诊断策略和治疗方法开辟了一条新途径。
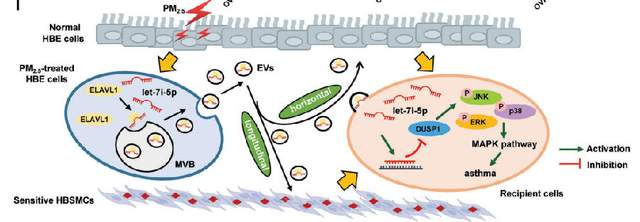
图1 经PM2.5处理的HBE细胞分泌EVs包装的 let-7i-5p,通过调节其靶基因DUSP1的表达,激活受体细胞中的MAPK信号通路,诱导哮*
2. 自噬参与肥胖哮*小鼠模型中嗜酸性气道炎症的恶化
肥胖是哮*患者的常见合并症,肥胖哮*患者在重度哮*患者中表现出最难治的表型。日本滨松大学医学院Takafumi Suda团队猜测自噬参与肥胖哮*的发病机制[2]。与野生型肥胖小鼠相比,屋尘螨 (HDM) 致敏的atg5-/-(自噬相关蛋白)肥胖小鼠表现出明显的嗜酸性粒细胞炎症和气道高反应性 (AHR)。对atg5-/-肥胖小鼠的分析显示,Th2细胞水平增加,但ILC2细胞水平没有增加,同时肺中Th2细胞因子表达升高。HDM 致敏的atg5-/-小鼠出现胸腺基质淋巴细胞生成素(TSLP)和 IL33 依赖性嗜酸性粒细胞炎症和 AHR(图2)。该研究结果表明,异常自噬有助于肥胖哮*中嗜酸性粒细胞炎症的恶化。自噬的调节可能是肥胖相关哮*的治疗靶点。

图2 HDM 致敏的atg5-/-肥胖小鼠会出现TSLP依赖性和IL33依赖性哮*
3. 赖氨酰氧化酶样蛋白2在哮*中增加并有助于哮*气道重塑
气道平滑肌细胞 (ASM) 是哮*发病机制的基础,影响支气管收缩、气道高反应性和气道重塑。细胞外基质 (ECM) 可以影响组织重塑途径。因此,英国诺丁汉大学医学院Amanda L Tatler团队假设 ASM 对 TGFβ 的激活受哮*中 ECM 的影响,并试图研究所涉及的机制[3]。他们发现来自哮*患者的 ASM 细胞比非哮*对照激活更多的 TGFβ,并且患病细胞衍生的 ECM 影响激活的 TGFβ 水平。ECM 交联酶赖氨酰氧化酶样蛋白2(LOXL2) 在哮* ASM 细胞和支气管活检中增加。LOXL2 抑制可降低体外 ECM 硬度和 TGFβ 活化,并可以减少上皮下胶原沉积和 ASM 厚度(气道重塑的两个特征)(图3)。这些数据强调了 LOXL2 在哮*气道重塑发展中的作用,并表明 LOXL2 抑制可作为减少严重哮*气道重塑的潜在疗法。
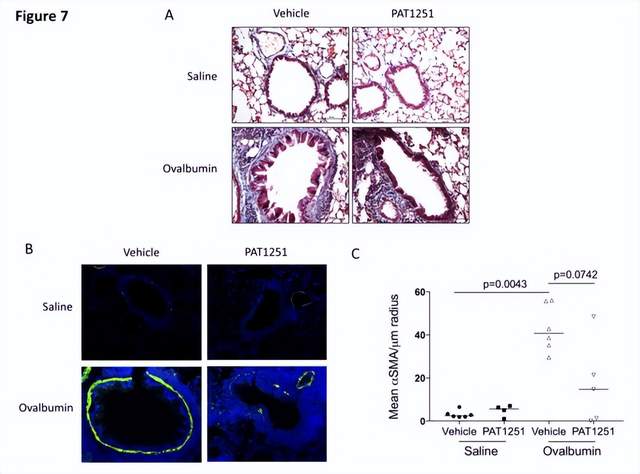
图3 体内LOXL2抑制可减少慢性卵清蛋白刺激诱导的气道重塑
4. 细菌触发诱导的制瘤素 M 表达驱动严重哮*患者的气道炎症和粘液分泌
在哮*中观察到细菌生态失调和机会性细菌感染,并且可能导致更严重的哮*。美国Genentech公司Mark S. Wilson团队发现细菌脂多糖(LPS)诱导癌抑素M (OSM),并且严重哮*患者的气道活检存在OSM驱动的转录谱[4]。这一特征与炎症和粘液产生途径的激活相关。通过用 OSM 特异性抗体阻断 OSM,他们证明LPS 诱导的巨噬细胞 OSM 对于将细菌衍生信号转化为过敏反应是必要的(图4)。使用肺炎克雷伯菌模型,OSM 阻断可减少气道中性粒细胞增多和 Muc5ac、Muc5b 和 Clca1 基因表达,而不会影响 IL1a、IL1b 和 IL6 的表达或抗菌免疫,说明了细菌驱动的 OSM 对病理学而不是免疫的重要作用。总之,这些数据为抑制OSM以防止严重哮*的细菌相关进展和加重提供了理论基础。
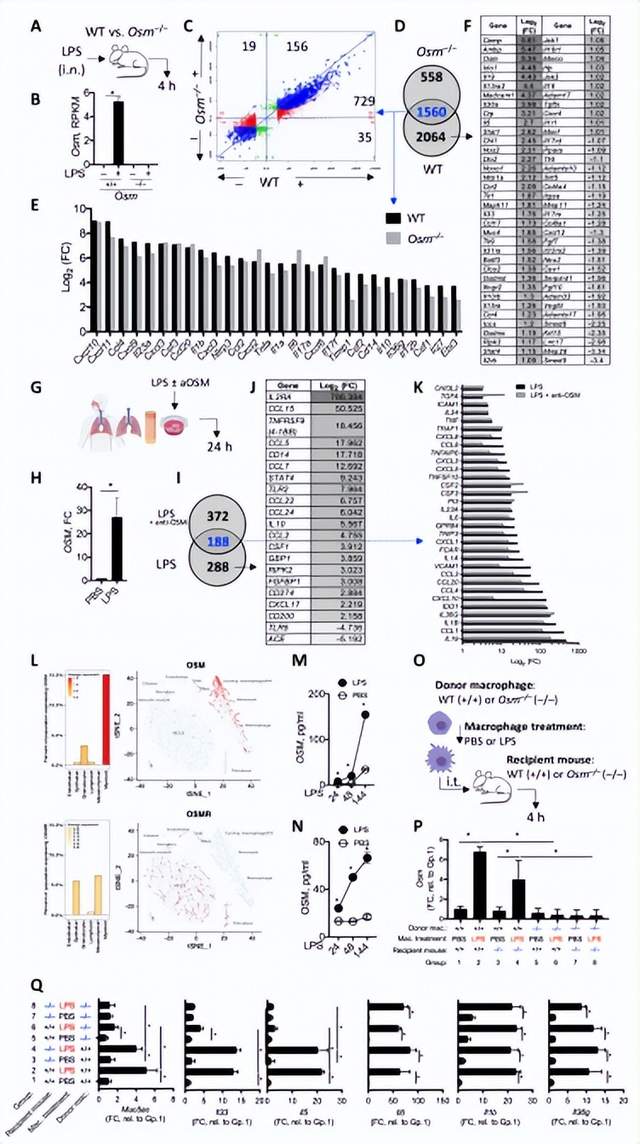
图4 暴露于LPS信号后,OSM会引发组织炎症
参考文献
[1] Zheng R, Du M, Tian M, et al. Fine Particulate Matter Induces Childhood Asthma Attacks via Extracellular Vesicle-Packaged Let-7i-5p-Mediated Modulation of the MAPK Signaling Pathway [J]. Adv Sci (Weinh). 2022, 9(3):e2102460.(IF=16.806)
[2] Suzuki Y, Aono Y, Akiyama N, et al. Involvement of autophagy in exacerbation of eosinophilic airway inflammation in a murine model of obese asthma [J]. Autophagy. 2022, 1-13.(IF=16.016)
[3] Ramis J, Middlewick R, Pappalardo F, et al. Lysyl oxidase-like 2 is increased in asthma and contributes to asthmatic airway remodelling [J]. Eur Respir J. 2022, 2004361.(IF=16.671)
[4] Headland SE, Dengler HS, Xu D, et al. Oncostatin M expression induced by bacterial triggers drives airway inflammatory and mucus secretion in severe asthma [J]. Sci Transl Med. 2022;14(627):eabf8188.(IF=17.956)
云克隆不仅可提供哮*动物模型,也涵盖其他常见呼吸系统疾病(慢性阻塞性肺疾病、支气管炎、肺栓塞、肺炎、肺纤维化等)动物模型。还具有各类肺疾病检测指标相关产品,可助力广大科研工作者进行呼吸系统疾病相关研究。