隔日禁食 (ADF)是目前流行的热量限制形式之一,已有动物及临床研究显示ADF可改善代谢健康,但其驱动机制尚不清楚。有研究发现ADF可能在胰岛素敏感性方面具有重要作用,而肝脏在胰岛素作用和血糖管理方面都发挥着至关重要的作用,其中与复杂的线粒体代谢密不可分。但肝脏线粒体是否参与或如何参与ADF介导的代谢益处尚不清楚。西安交通大学冯智辉/刘健康教授团队等通过代谢组学等技术揭示肝脏在ADF介导的代谢益处的关键作用,并表明靶向肝脏线粒体复合物Ⅱ可能是对抗代谢紊乱的新策略,相关成果发表于《Advanced Science》。麦特绘谱提供代谢组学检测服务。

1. ADF通过扰乱线粒体复合物Ⅱ组装促进肝脏代谢重塑
本研究中,小鼠接受定期喂养或ADF干预4周,每4天监测一次体重和食物摄入量。ADF组小鼠在干预1周后体重增加减慢,而两组之间食物摄入量相当。ADF组小鼠血清 ALT、AST、TC、TG、肌酐、尿素和空腹胰岛素水平与对照组无显著差异,而ADF组小鼠葡萄糖耐量和胰岛素敏感性显著提高。肝脏组织代谢组学研究发现47种代谢物在ADF和对照组之间存在显著差异,这些变化主要与氨基酸代谢有关。
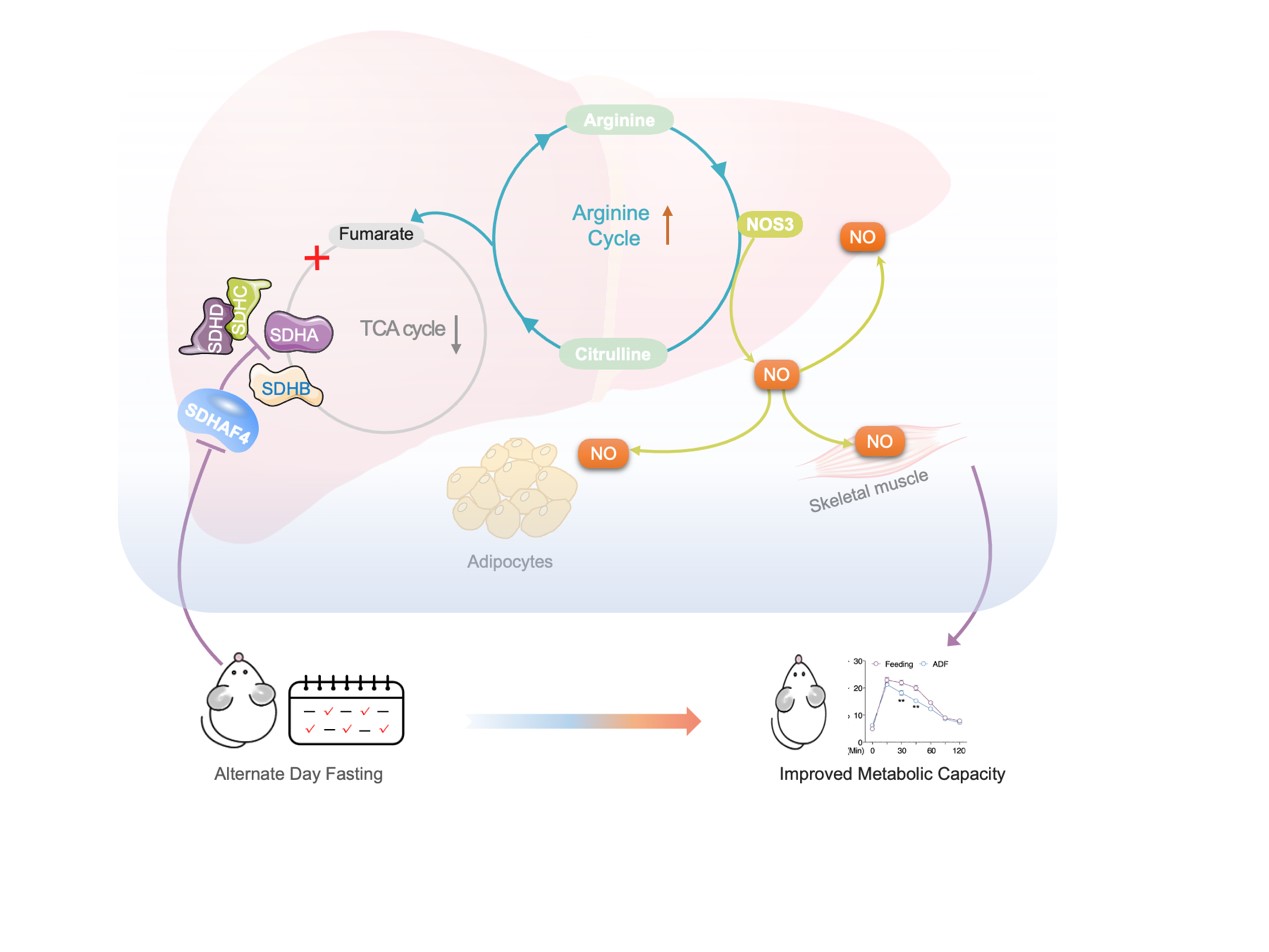
由于线粒体是将非必需氨基酸代谢与三羧酸(TCA)循环耦合的关键细胞器,随后对线粒体展开相关研究。结果表明,在肝脏组织中,电子传递链 (ETC)五种复合物中只有线粒体复合物Ⅱ(又称线粒体琥珀酸脱氢酶,SDH)活性在ADF组中显著降低,而其在外周组织则无显著差异。线粒体复合物Ⅱ四个亚基mRNA转录和蛋白表达水平无差异,且ADF也未改变其他线粒体复合物亚基mRNA转录水平。但是,ADF显著改变线粒体复合物Ⅱ组装因子——琥珀酸脱氢酶组装因子 2 (SDHAF2) 和 SDHAF4蛋白质表达水平。其中,ADF不仅显著降低了 SDHAF4蛋白表达水平,且导致SDHAF4与SDHB结合减少,从而破坏了SDHA与SDHB进一步结合。因此,ADF干预诱导线粒体复合物 Ⅱ 活性降低,主要原因为SDHAF4表达降低进而抑制线粒体复合物 Ⅱ的组装(图 1)。
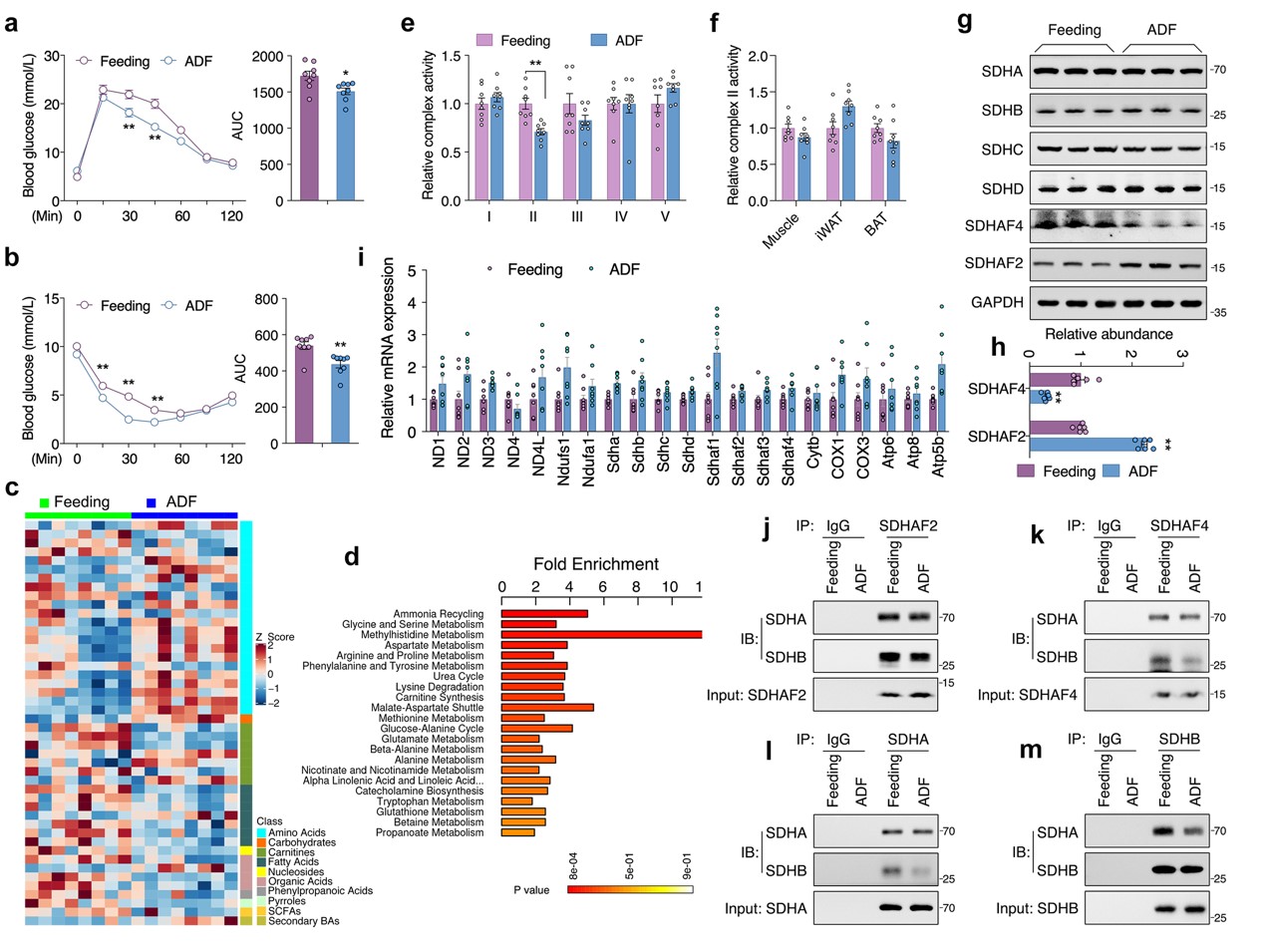
图1. ADF通过抑制线粒体复合物Ⅱ的组装促进肝脏代谢重塑
2. 肝脏Sdhaf4敲除抑制线粒体复合物II,但不影响表型
构建肝脏特异性Sdhaf4基因敲除小鼠(Sdhaf4Alb KO)进一步探索肝脏SDHAF4介导的复合物Ⅱ功能障碍对代谢的影响。结果显示,Sdhaf4敲除对小鼠血清ALT、AST、TC、TG水平无显著影响。与ADF组小鼠一致,Sdhaf4Alb KO小鼠线粒体复合物亚基表达水平趋势相似,SDH亚基SDHA和SDHB蛋白水平显著降低,而复合物 ⅡI、IV和V活性降低不显著。SDHA/SDHB结合和泛素修饰的免疫沉淀分析表明SDH蛋白水平降低归因于泛素修饰增强和蛋白降解。
线粒体复合物 Ⅱ 活性降低会抑制线粒体三磷酸腺苷 (ATP)产生,结果表明,在Sdhaf4Alb KO小鼠和ADF组小鼠中,ATP产生减少。不过ATP产生减少并未影响AMPK、mTOR信号、线粒体自噬活性。HE染色结果表明, Sdhaf4Alb KO小鼠肝脏结构正常。电子显微镜显示Sdhaf4Alb KO小鼠线粒体微观结构和数量未改变,这表明,肝脏中SDHAF4的缺失会抑制线粒体活性,但不会引起剧烈的线粒体应激。Sdhaf4Alb KO小鼠表现出正常的能量代谢,包括总活动、O2消耗、CO2产生、热量产生、食物摄入和呼吸交换。Sdhaf4Alb KO小鼠粪便成分和卡路里变化与对照组相似。对肝脏进行胆汁酸谱检测,鹅去氧胆酸 (CDCA) 和 7-酮石胆酸 (7-Keto LCA)发生显著改变。总之,肝脏中SDHAF4缺失对小鼠的能量吸收/利用无显著影响(图2)。
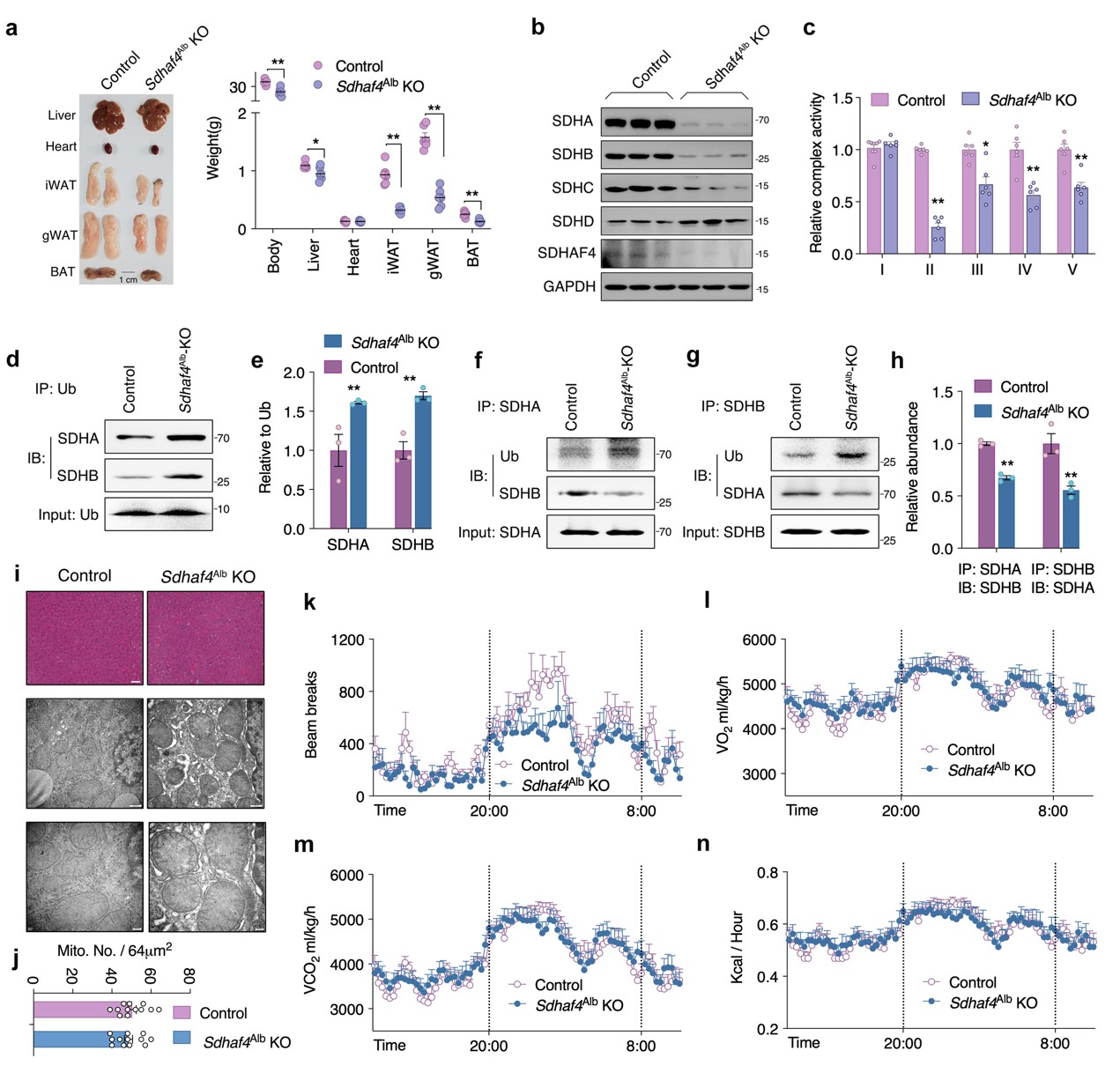
图2. 肝脏Sdhaf4敲除破坏线粒体复合物,但不影响表型
3. Sdhaf4 敲除提高小鼠全身代谢敏感性
Sdhaf4Alb KO和对照小鼠之间血脂、空腹血糖和空腹胰岛素水平保持相似。不过Sdhaf4Alb KO小鼠口服葡萄糖耐量和胰岛素敏感性显著改善,与ADF组一致。此外,KO小鼠在胰岛素诱导后肝脏、肌肉(股四头肌)和腹股沟白色脂肪组织(iWAT)中丝氨酸/苏氨酸激酶(Akt)磷酸化显著增加。通过转染腺病毒来过表达肝脏Sdhaf4,结果表明,Sdhaf4过表达显著恢复Sdhaf4Alb KO小鼠肝脏中的SDHA和SDHB蛋白水平,而不影响血清脂质水平。同时,过表达并未改变对照小鼠的葡萄糖和胰岛素耐受性,但显著降低Sdhaf4Alb KO小鼠的葡萄糖和胰岛素耐受性。在恢复SDHAF4水平后,Sdhaf4Alb KO小鼠Akt 磷酸化也降低,进一步说明肝脏SDHAF4缺失对改善全身代谢能力的驱动作用。此外,对 Sdhaf4Alb KO小鼠进行长达12个月的观察及小鼠肢体力量测试等分析,揭示对照组和Sdhaf4Alb KO小鼠在 2、6 和12个月龄存在相似变化,提示抑制肝脏线粒体复合物 Ⅱ 组装可能是改善全身代谢益处安全有效的策略(图 3)。
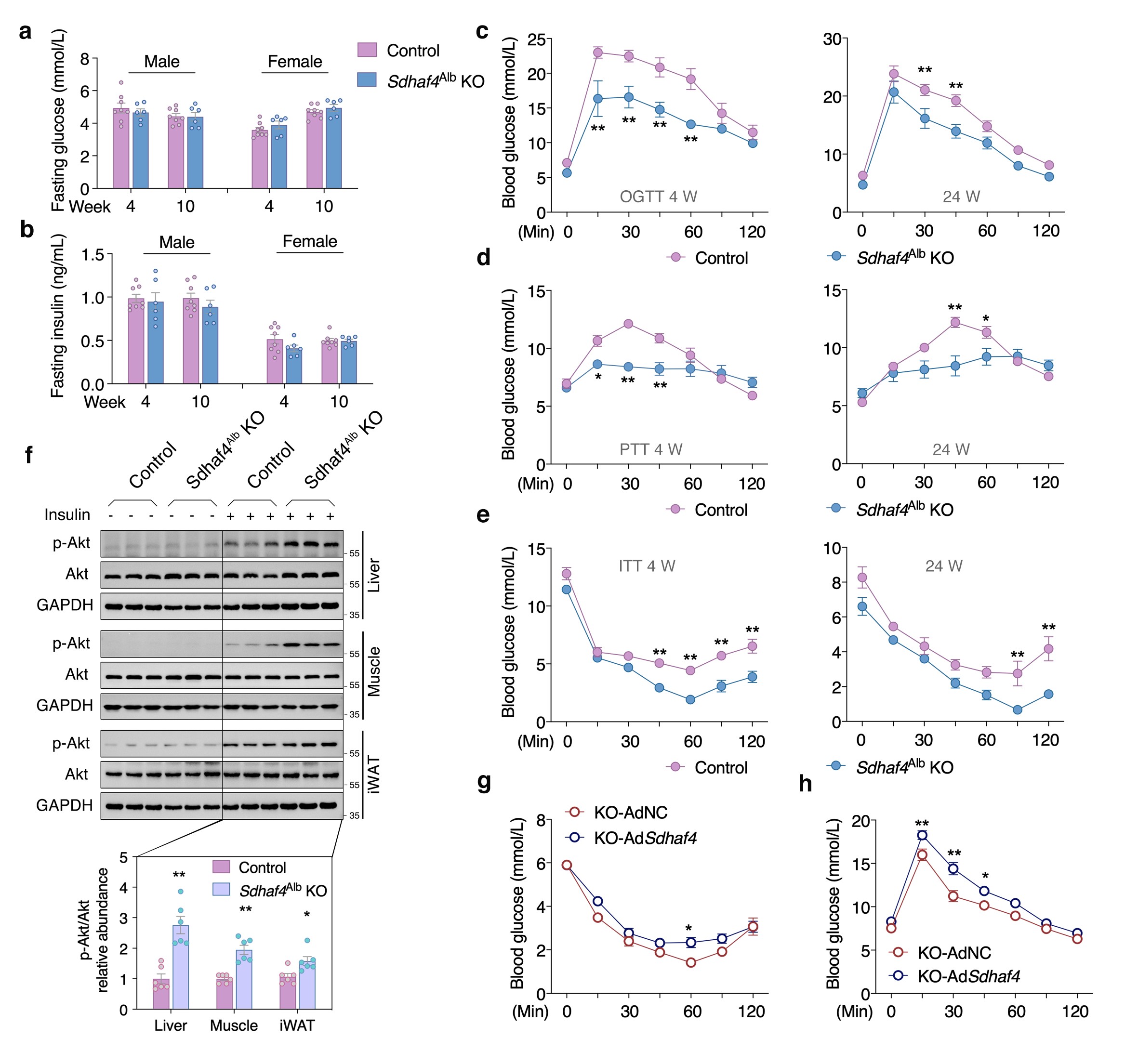
图3. 肝脏 Sdhaf4 敲除提高小鼠的全身代谢敏感性
由于肝脏SDHAF4缺失改善了代谢能力,随后评估对代谢应激的益处。在喂食高脂饮食(HFD)12 周后,Sdhaf4Alb KO小鼠表现出对 HFD诱导的体重增加的显著抵抗,以及对WAT 增加的抵抗,肝脏、棕色脂肪组织 (BAT)、性腺 WAT (gWAT) 和 iWAT 的H&E染色结果进一步佐证。此外,HFD喂养下Sdhaf4Alb KO小鼠肝脏甘油三酯和总胆固醇水平显著降低。Sdhaf4Alb KO小鼠在 HFD 喂养下仍表现出葡萄糖和胰岛素耐受性显著改善。同时,肝脏、肌肉和 iWAT 中胰岛素刺激的 Akt 磷酸化显著增加。这些结果表明Sdhaf4Alb KO小鼠在常规甚至HFD 环境下都保持较好的代谢敏感性(图4)。
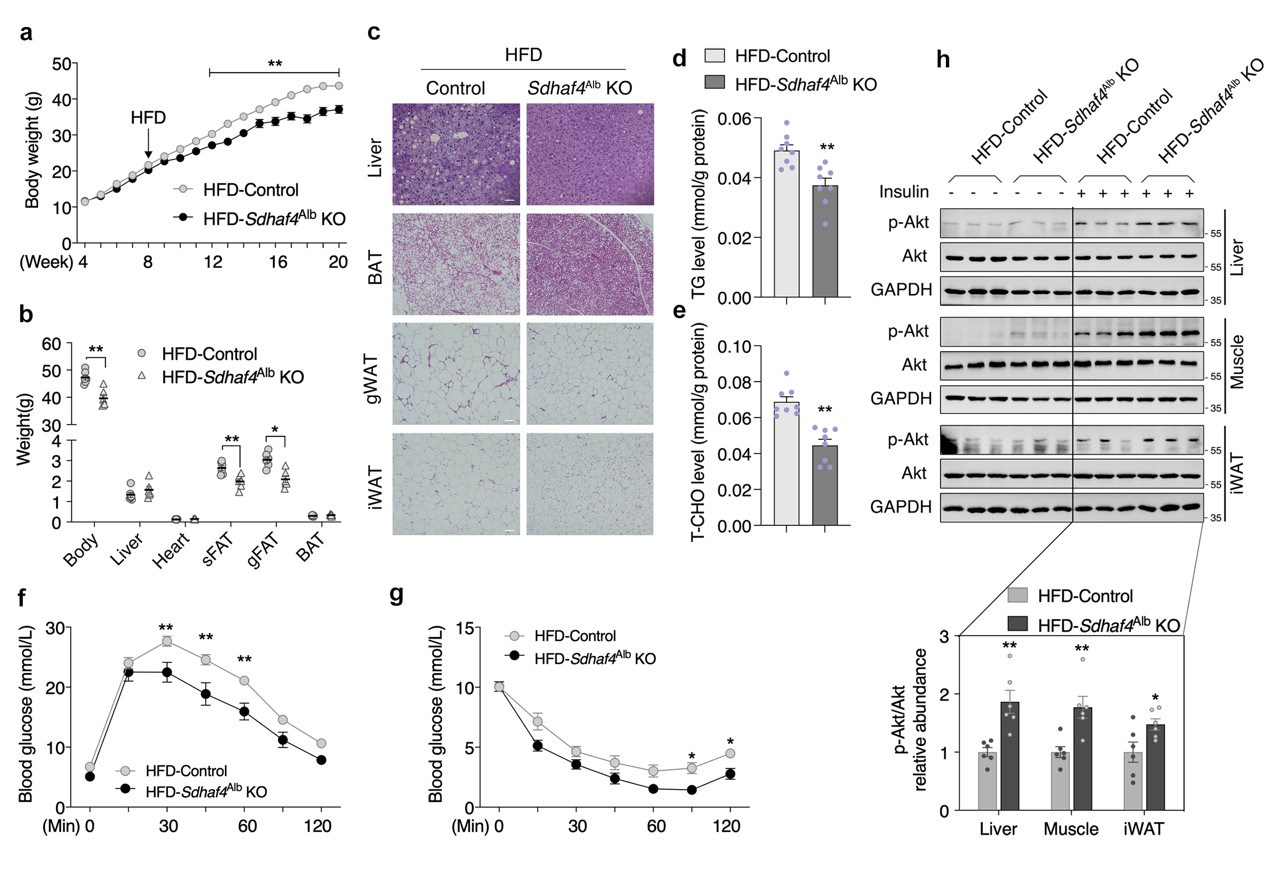
图4. 肝脏中SDHAF4的缺失保护小鼠免受代谢压力
4. 抑制线粒体复合物 Ⅱ 组装可促进氨基酸代谢
在线粒体五种复合物中,复合物Ⅱ是唯一已知的同时参与 TCA 循环和电子传递链的复合物。SDHAF4缺失破坏了复合物Ⅱ的组装,从而促进SDH亚基降解。因此,猜测Sdhaf4Alb KO小鼠肝脏TCA活性发生显著抑制。将对照组和Sdhaf4Alb KO小鼠肝组织进行代谢组学研究,Sdhaf4Alb KO小鼠肝脏中氨基酸增多和碳水化合物降低。生化检测和染色结果表明, Sdhaf4Alb KO小鼠糖原水平降低。糖原基因Pgc-1、FoxO1、Pck1和G6pc表达显著降低,表明糖异生受到抑制,这可能是由于胰岛素信号传导增加所致。
SDHAF4缺失影响了TCA循环中的富马酸和苹果酸水平,且它们在 Sdhaf4Alb KO小鼠显著增加,提示存在响应SDH功能障碍的补偿通路。尽管 Sdhaf4Alb KO小鼠和ADF组小鼠ATP水平均降低,但NAD+和NADH均无显著影响,表明尽管SDH活性受到抑制,Sdhaf4Alb KO小鼠和ADF组小鼠仍能实现功能性TCA循环。通路富集结果表明,氨基酸代谢是受影响最大的通路。已有研究报道精氨酸代谢与TCA循环密切相关。精氨酸由精氨酸琥珀酸合酶 (ASS) 和精氨酸琥珀酸裂解酶 (ASL) 生成,产生的副产物富马酸转化为苹果酸进而生成草酰乙酸,用于生成天冬氨酸进入精氨酸合成循环。同时,精氨酸代谢为鸟氨酸和尿素,进行尿素循环。这些数据提示,抑制复合物 Ⅱ 组装可以激活精氨酸生物合成通路以维持富马酸水平,从而维持体内TCA代谢功能(图 5)。
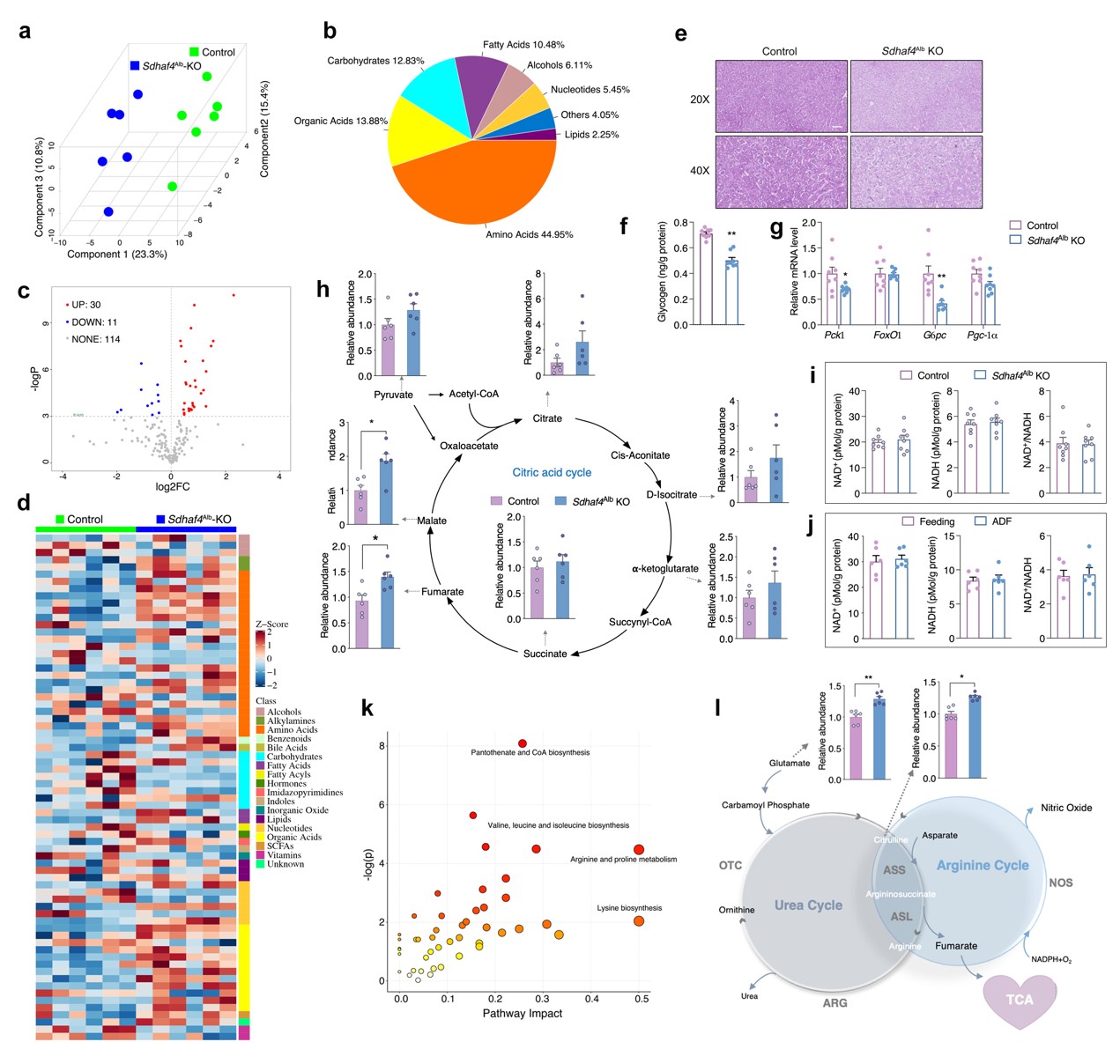
图5. 抑制线粒体复合物 Ⅱ 组装可促进氨基酸代谢
5. SDHAF4缺失激活精氨酸-NO循环以改善小鼠胰岛素敏感性
肝脏SDHAF4缺失可以改善胰岛素敏感性,这提示存在中间介质从肝脏释放进入循环系统。血清代谢组学分析发现,精氨酸生物合成是Sdhaf4Alb KO小鼠中受影响的显著通路,且瓜氨酸显著增加。瓜氨酸是由一氧化氮合酶 (NOS) 催化产生,该反应还产生一氧化氮 (NO),NO是多种生理过程中的关键调节剂,因此探究NO是否是调节代谢益处的关键效应物。结果表明,Sdhaf4Alb KO和ADF组小鼠血清NO水平均升高,肝脏中NOS1 和 NOS3 表达也显著增加,而在其他组织中未观察到这种变化,提示精氨酸-NO循环在Sdhaf4Alb KO和ADF组小鼠肝脏中被激活。通过饮用水添加NOS抑制剂(N-**-L-精氨酸甲酯,L-NAME) 来抑制Sdhaf4Alb KO和ADF组小鼠NO,结果显示,L-NAME显著消除葡萄糖耐量和胰岛素相关的Akt 磷酸化。此外,L-NAME 也可消除Sdhaf4Alb KO小鼠对 HFD 诱导的代谢保护。
为探究肝脏代谢调节作用对肌肉和脂肪组织的影响,对原代肝细胞与小鼠 C2C12 肌管或 3T3-L1脂肪细胞进行共培养。与Sdhaf4Alb KO小鼠肝细胞共培养的 C2C12 或 3T3-L1 细胞中Akt磷酸化显著增加。循环系统中的NO 是否作用于靶组织,分析结果显示,Sdhaf4Alb KO小鼠和ADF组小鼠肝脏、肌肉和 iWAT 中NO下游因子cGMP(环磷鸟嘌呤核苷)显著增加。而且,在有或无L-NAME处理的情况下,Sdhaf4Alb KO小鼠靶组织中cGMP 水平与NO水平变化一致。为阐述组织胰岛素敏感性增强是NO直接作用,Sdhaf4Alb KO小鼠进行短期L-NAME干预,肝脏中NO的产生和血清中NO水平显著抑制,且肝脏、脂肪和肌肉中胰岛素信号改善被显著抑制。这些数据提示,肝脏SDHAF4-精氨酸轴驱动NO产生并通过 cGMP 信号靶向外周组织以增强胰岛素敏感性(图 6)。
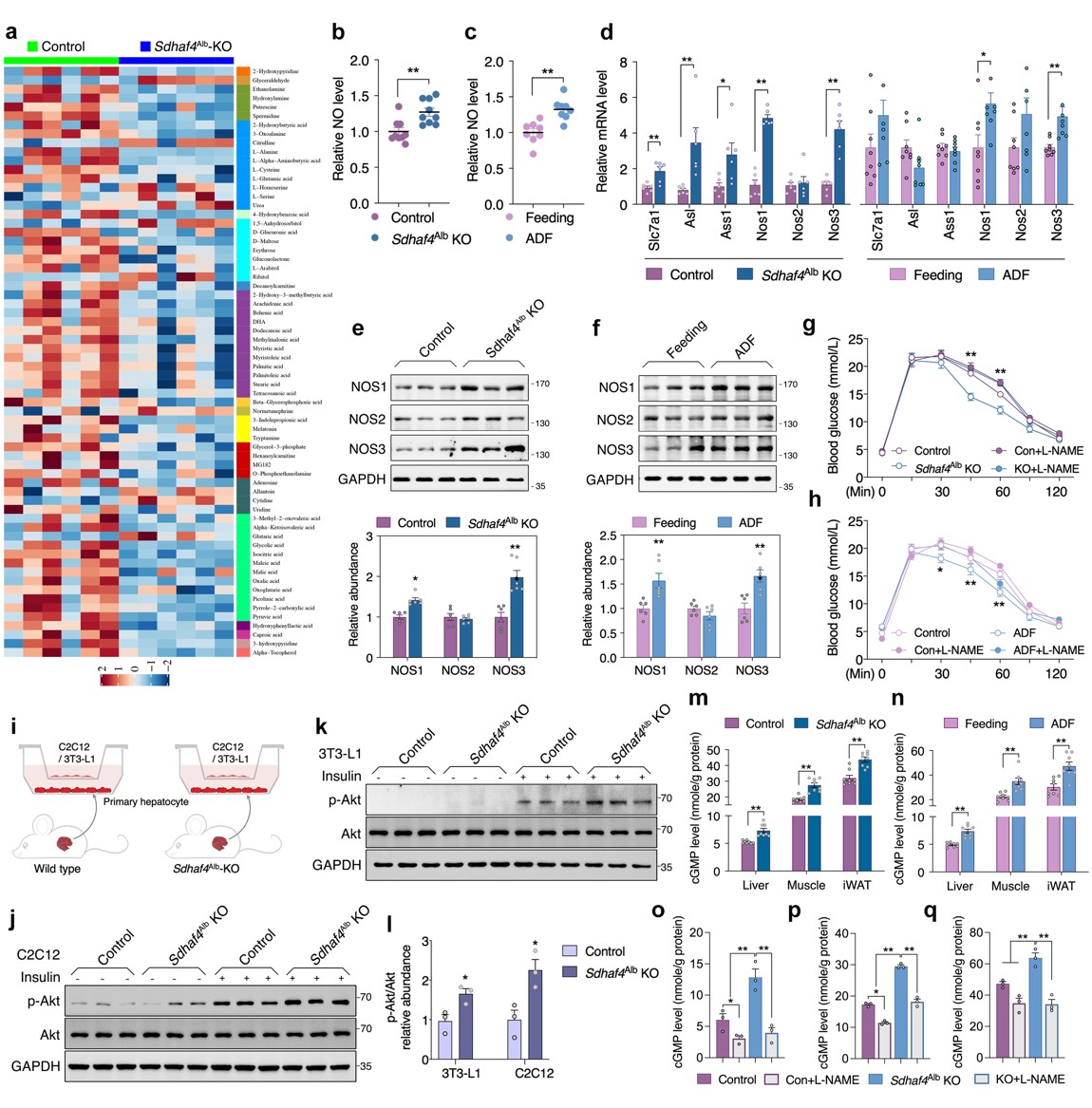
图6. SDHAF4 的肝脏缺失激活精氨酸-NO循环以改善小鼠胰岛素敏感性
6. 肝脏NOS3是循环NO变化的原因
由于实验组小鼠肝脏中NOS1和NOS3均显著增加,因此进一步确定NO来源。用3种NOS 抑制剂处理Sdhaf4Alb KO小鼠原代肝细胞共培养的 C2C12 肌管,结果显示,NOS3抑制剂显著抑制胰岛素诱导的Akt磷酸化,表明NOS3介导的NO产生可能是Sdhaf4Alb KO或ADF组小鼠全身代谢改善的原因。随后构建肝脏Nos3敲除小鼠,其肝脏中Nos3表达和血清中NO水平均降低50%。对Nos3敲除小鼠进行ADF干预,Nos3敲除小鼠中葡萄糖和胰岛素耐受被抑制,胰岛素诱导的Akt磷酸化降低。Sdhaf4Alb KO小鼠与Nos3敲除小鼠进行杂交的小鼠表现出Sdhaf4完全缺失和肝脏Nos3 50% 表达。与Sdhaf4Alb KO小鼠相比,杂交小鼠NO循环水平显著降低。同时,Nos3敲低也显著降低Sdhaf4Alb KO小鼠中Akt磷酸化水平,且显著抑制Sdhaf4Alb KO小鼠的葡萄糖和胰岛素耐受能力。这些数据表明,肝脏NOS3 影响NO循环水平,SDHAF4-精氨酸-NO轴是调节ADF介导的代谢益处的潜在机制(图7)。
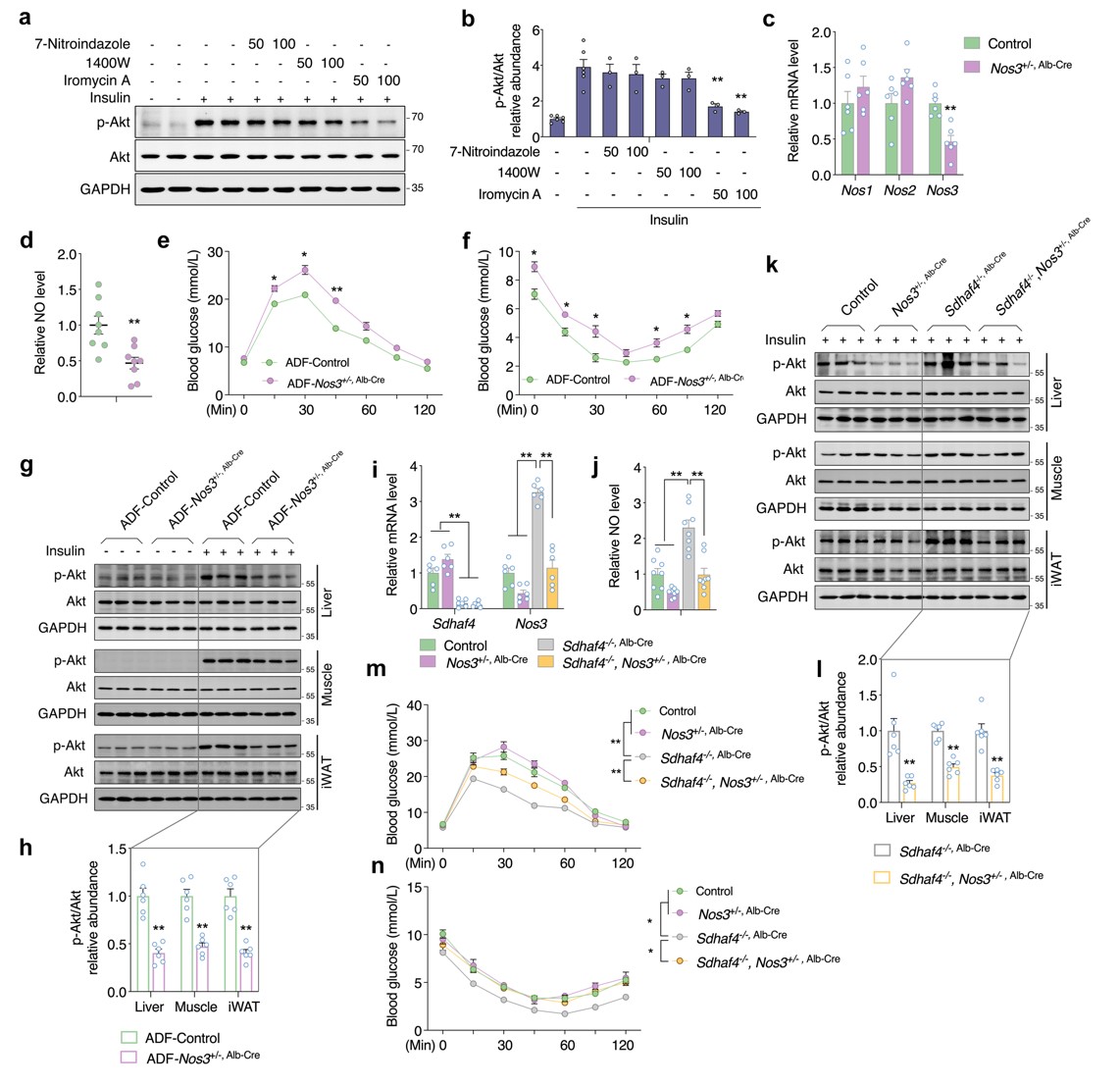
图7. 肝脏NOS3是代谢改善小鼠循环NO的原因
7. 肝脏Sdhaf4过表达减弱ADF对胰岛素敏感性的改善作用
构建肝脏Sdhaf4过表达小鼠,在ADF干预下,转染过表达载体的小鼠的葡萄糖耐量和胰岛素敏感性显著降低,组装因子和SDH亚基转录表达无影响。此外,Sdhaf4过表达显著改善了ADF诱导的线粒体复合物 Ⅱ 活性和SDH亚基组装。Nos1、Nos3、Slc7a1 表达和血清 NO 水平降低,表明肝脏精氨酸-NO循环未被激活。肝脏、肌肉和 iWAT 组织中Akt磷酸化降低,表明肝脏 Sdhaf4 过表达显著抑制ADF干预小鼠全身胰岛素敏感性的提高。这些数据揭示了肝脏中高度动态和互作的线粒体代谢网络,表明抑制肝脏复合物 Ⅱ 组装可能是改善代谢能力的潜在策略(图8)。
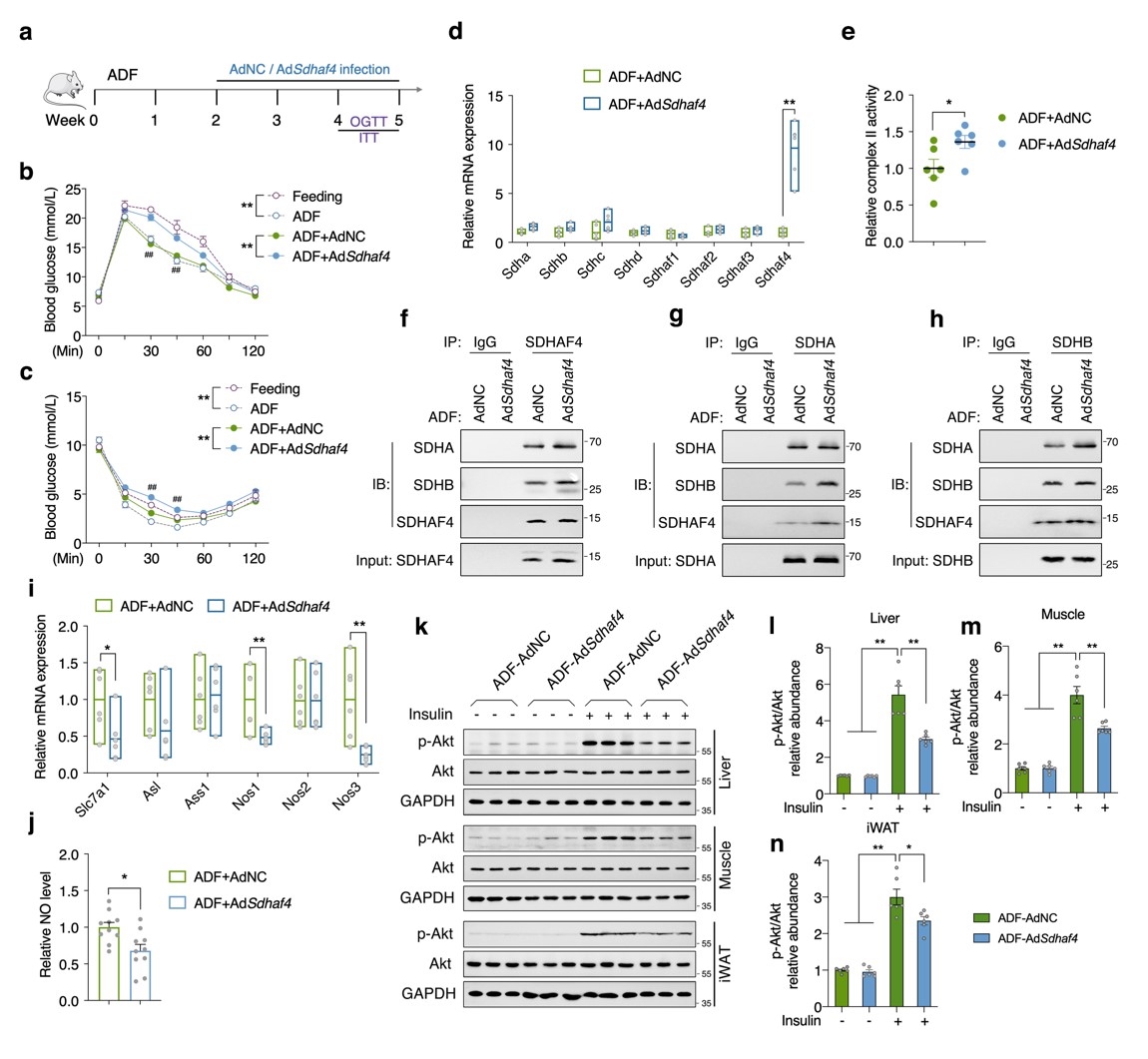
图8. 肝脏Sdhaf4过表达减弱ADF小鼠对胰岛素敏感性的改善
小结
本研究揭示肝脏在ADF干预期间经历了显著的代谢重编程,主要通过抑制组装因子SDHAF4进而抑制线粒体复合物 Ⅱ 组装。机制上,肝细胞激活精氨酸– NO轴以响应线粒体复合物Ⅱ和TCA循环,释放NO增强多组织胰岛素敏感性。这些结果突出了肝脏在ADF相关全身益处中的关键作用,并表明靶向肝脏线粒体复合物 Ⅱ 组装可能是对抗代谢紊乱的新策略。
西安交通大学冯智辉教授团队长期探讨线粒体调控网络参与代谢、衰老相关疾病的发生机制及靶向干预策略(https://gr.xjtu.edu.cn/en/web/zhfeng)。近期受邀在Pharmaceuticals(IF, 5.863)中开设线粒体研究的一个特刊 “Mitochondria Targeted Pharmaceuticals in Aging Associated Diseases”,欢迎感兴趣的老师同学前往投稿,分享自己的研究成果。详细信息可参考如下链接:
https://www.mdpi.com/journal/pharmaceuticals/special_issues/Mitochondria_Aging_Diseases_Pharm
绘谱帮你测
麦特绘谱拥有业内强大的Q600全定量代谢组、Q300全定量代谢组、Q200宏代谢组等方法,可提供代谢组学一站式整体解决方案,独家的检测技术、全面的数据报告以及专业的售后探讨,助力您的科研探索之路不断创新和突破。详情欢迎咨询麦特绘谱热线400-867-2686,获取详细资料!
参考文献
Hepatic Suppression of Mitochondrial Complex Ⅱ Assembly Drives Systemic Metabolic Benefits. Advanced Science. 2022. https://doi.org/ 10.1002/advs.202105587.
阅读原文,请扫描下方二维码

往期推荐
1. 客户案例 | 2022开门红–Gut:人类衰老进程中肠道真菌演变及与代谢健康关系
3. Cell Metabolism | 代谢顶刊揭示轻断食促进长寿机制

