据WHO报道,每年约有1/10的住院患者并发由各种病原体所致的感染性疾病[1]。严重感染所致的免疫系统紊乱被称为细胞因子风暴[2]。表现为短时间内免疫细胞高反应状态及促炎细胞因子(如IL-6和TNF-α)和趋化因子的爆发性释放,已被认为是严重感染后导致患者多器官衰竭和死亡的主要原因之一[3]。
由严重急性呼吸综合征冠状病毒2 (SARS-CoV-2)感染所致的COVID-19在全球范围内引发大规模疫情,已成为重大公共卫生问题。研究指出SARS-CoV-2感染所致的免疫细胞紊乱及大量细胞因子的释放(如TNF-α和IL-6)是导致患者急性呼吸窘迫综合征和高死亡率的主要原因(高达~ 9.6%)[4]。临床迫切需要有效解决细胞因子风暴的治疗方法。
巨噬细胞是参与宿主防御的固有免疫细胞之一,广泛存在于所有组织,其表型的转换对免疫稳态的维持具有重要作用。巨噬细胞具有高度异质性,大致可分为两种亚型:M1型巨噬细胞(主要发挥促炎作用)和M2型巨噬细胞(主要发挥免疫调节及组织修复等作用)。细胞外囊泡(EVs)是由活细胞分泌的 (30~500nm)的纳米膜囊泡,携带多种亲代细胞来源的生物活性分子(蛋白质、核酸、脂类、代谢物等),具有与亲代细胞相似的生物活性[5],其作为治疗制剂具有低免疫原性/毒性和高组织穿透性等优点。然而,M2-EVs在细胞因子风暴中的治疗效果及具体机制尚不清楚。
近期,四川大学华西医院刘敬平研究员团队在Journal of Controlled Release杂志上发表题为Peritoneal M2 macrophage-derived extracellular vesicles as natural multitarget nanotherapeutics to attenuate cytokine storms after severe infections的文章,研究揭示腹腔M2巨噬细胞来源的细胞外囊泡(M2-EVs)可作为一种多靶点纳米药物,用于治疗病原体(细菌、病毒)感染所致的细胞因子风暴[6]。

结果
01 M2-EVs抑制细菌感染所致细胞因子风暴模型中的炎症水平
不同的来源的巨噬细胞生物活性不同。为了选择合适的细胞来源,研究人员首先比较了M2型腹腔巨噬细胞及264.7细胞系的抗炎能力,结果表明,原代M2细胞比固定化细胞系具有更强的抗炎功能。
研究人员分离腹腔M2-EVs并对其进行表征及功能检测。结果表明M2-EV可通过endocytosis、phagocytosis等多种途径被巨噬细胞摄取,显著抑制细菌LPS联合IFN-γ所致巨噬细胞模型中促炎因子的表达(如TNF-α和IL-6,图1)。
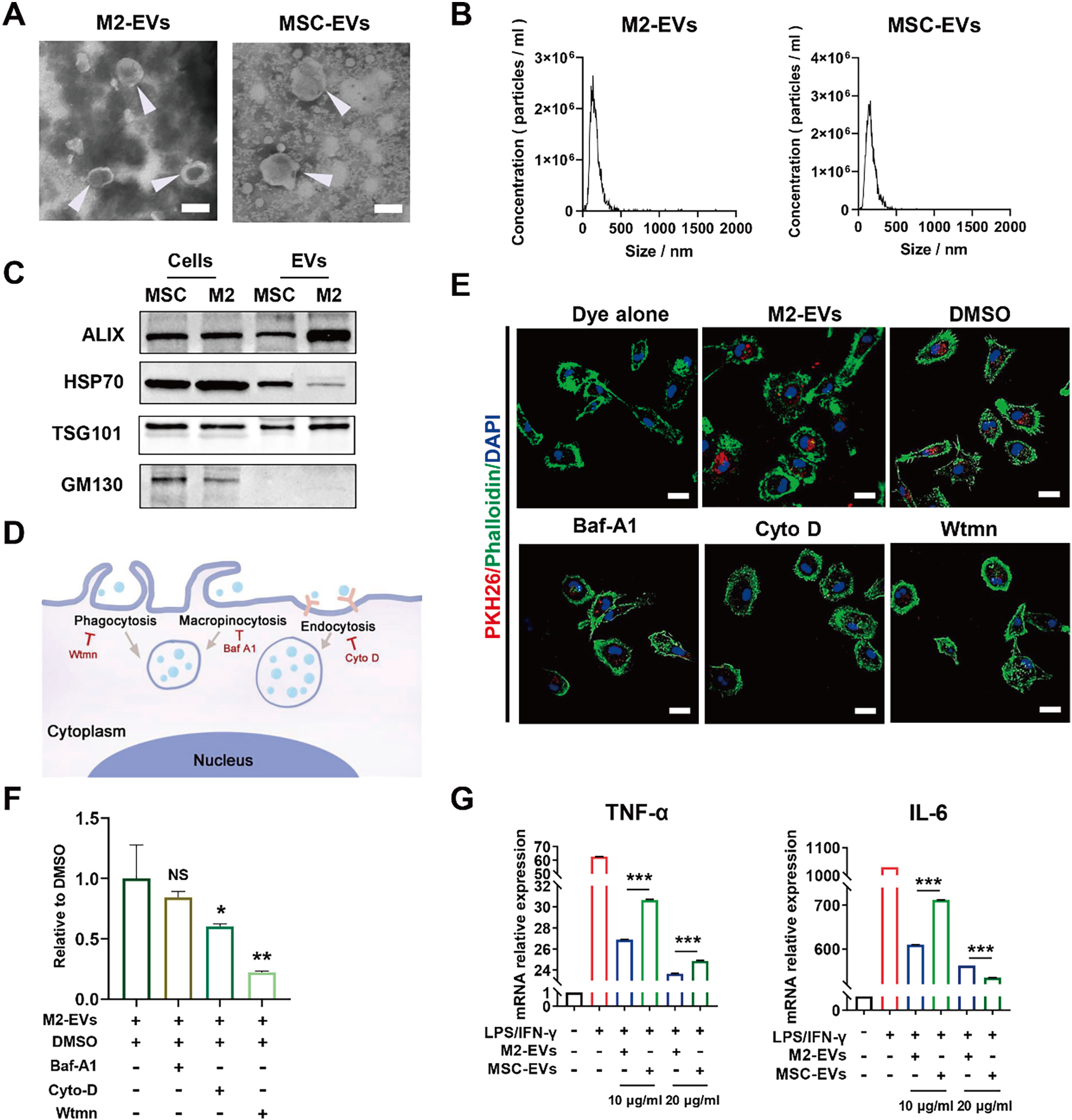
图1 体外研究M2-EVs的抗炎作用
M2-EV进入体内后可到达主要组织脏器(心、肝、脾、肺、肾),被组织巨噬细胞摄取(图2)。M2-EV干预可有效降低促炎M1细胞比例、血循环和多器官中促炎因子(如TNF-α和IL-6等)和趋化因子(如ICAM-1等)水平,从而减轻模型动物的氧化应激、细胞死亡和多器官损伤程度(图3)。
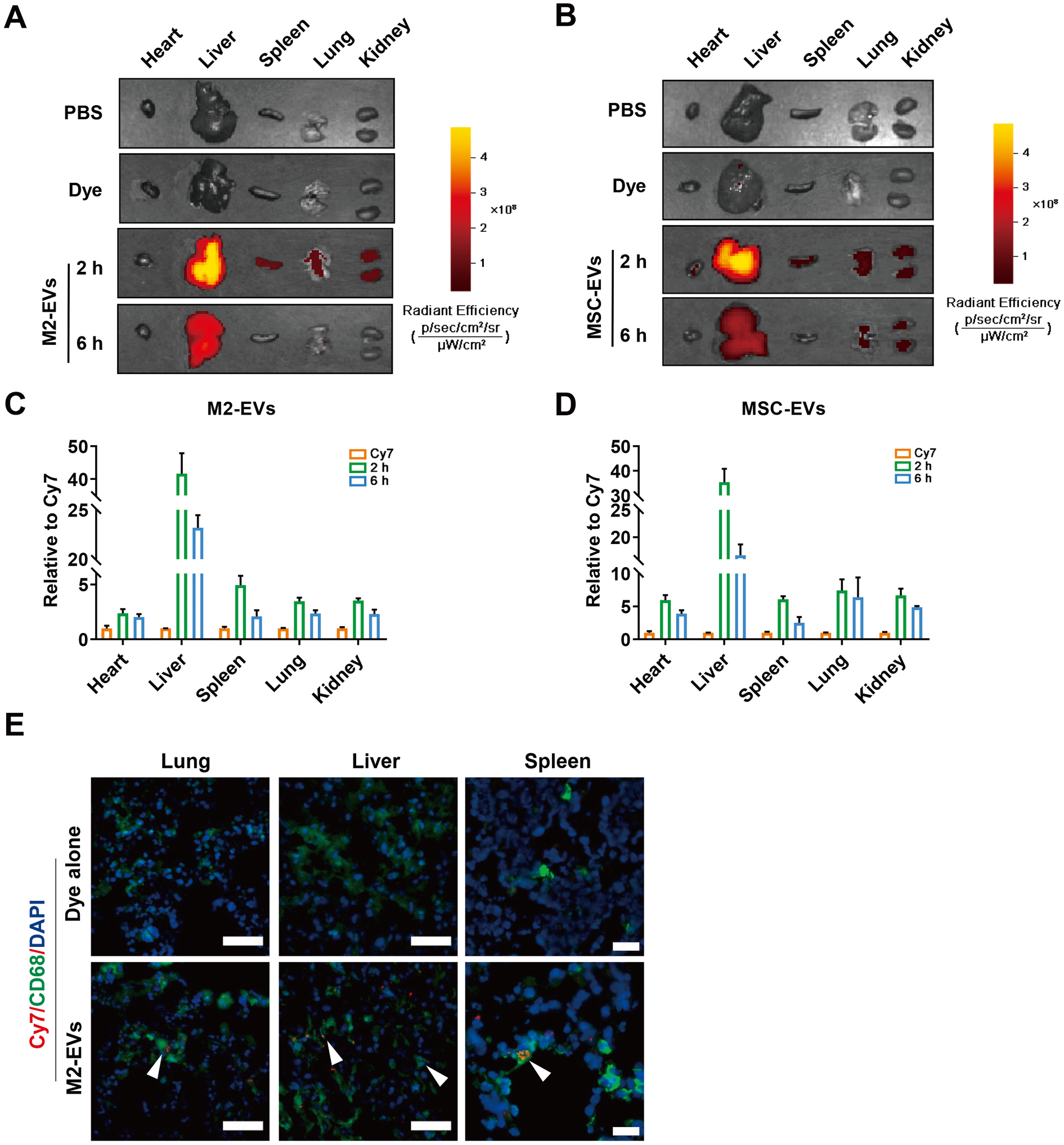
图2 M2-EVs的体内生物分布
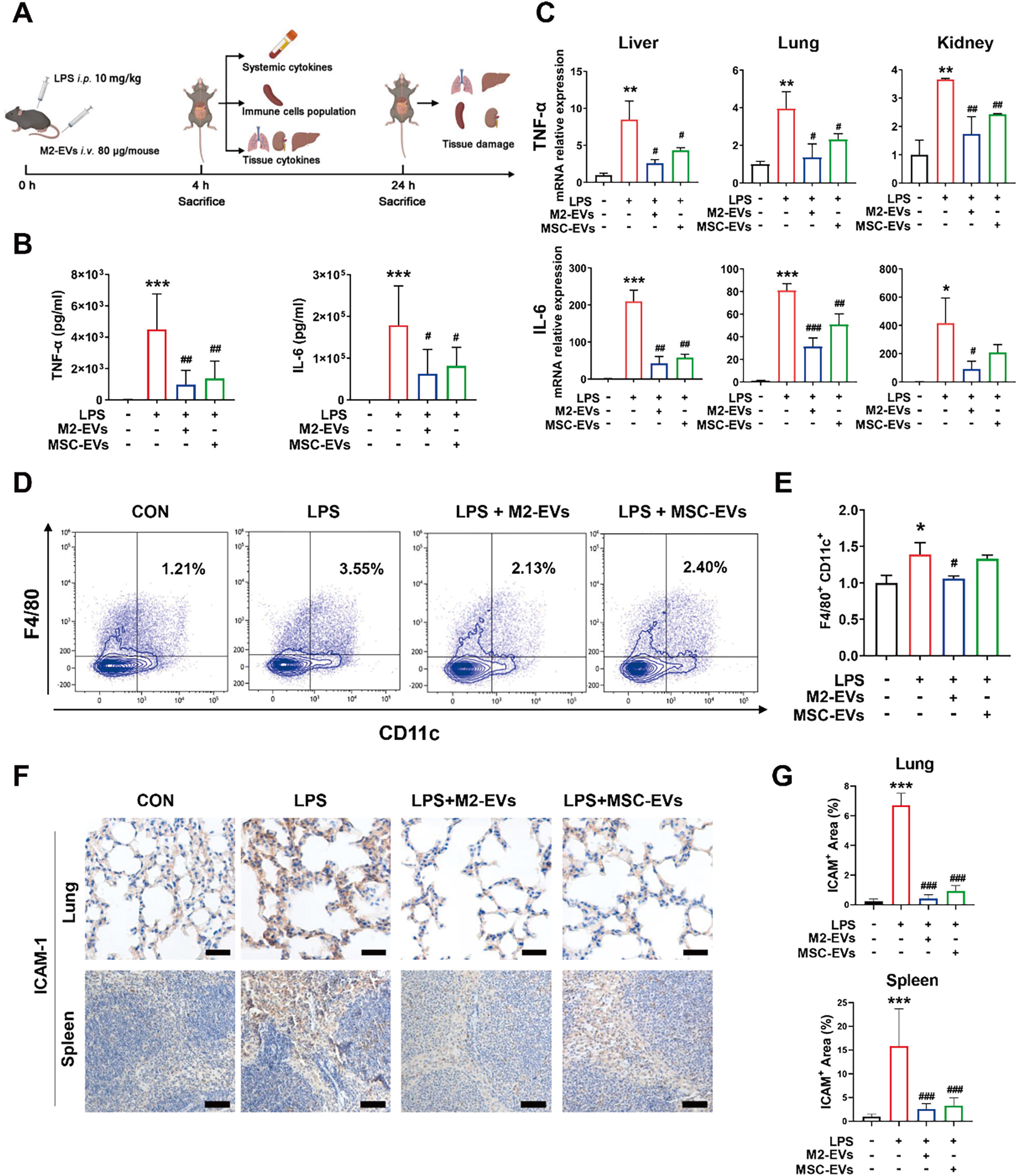
图3 体内研究M2-EVs的抗炎作用
02 M2-EVs多靶点抑制LPS模型多条促炎通路的激活
为了进一步揭示M2-EV潜在机制,研究人员分别对EV及EV干预的细胞进行了测序分析及分子学验证。结果显示,M2-EVs内含高丰度miRNAs(如miR-23b-3p, miR-378a-3p等)和蛋白(如IL-10, TGF-β等)等免疫调节活性分子, 并将其递送至促炎型M1-Mφ,通过miRNA-Gene/Gene-Gene网络多靶点同时抑制炎症反应中多条促炎通路(如NF-κB、p38 MAPK、JAK/STAT等)的激活,从而发挥免疫调节作用(图4-5)。
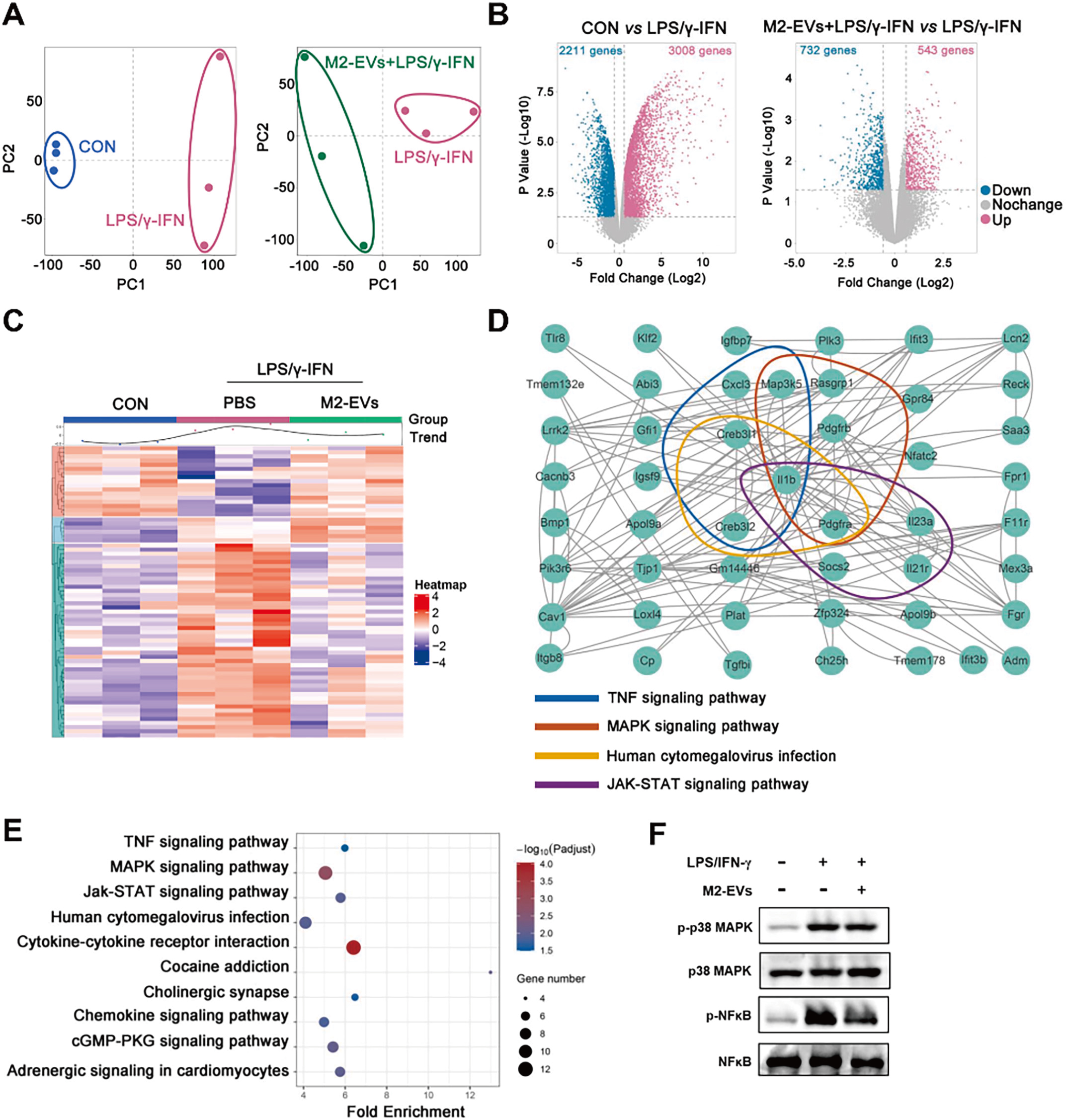
图4 M2-EVs干预改变转录组表达谱
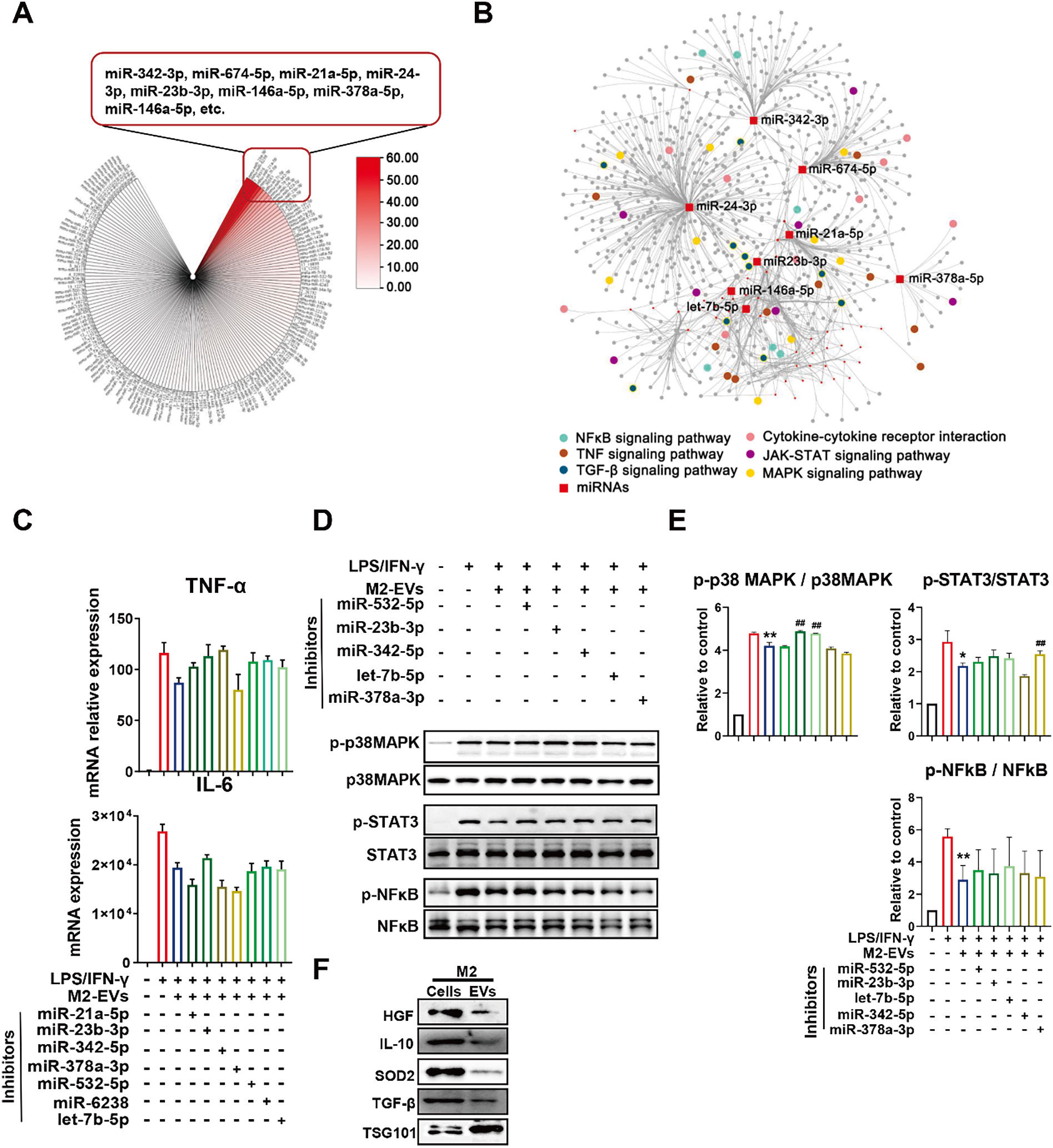
图5 体外研究M2-EVs的抗炎机制
03 M2-EVs作为纳米诱饵阻断SARS-CoV-2假病毒感染
有研究指出SARS-CoV-2主要通过其Spike蛋白与细胞表面ACE2(Angiotensin-converting enzyme 2)结合感染细胞。该研究结果表明,M2-EV高表达ACE2受体,可作为潜在纳米诱饵(nanodecoy)竞争性结合SARS-CoV-2假病毒,阻断病毒对细胞的感染,为COVID-19的治疗提供新思路。(图6)。
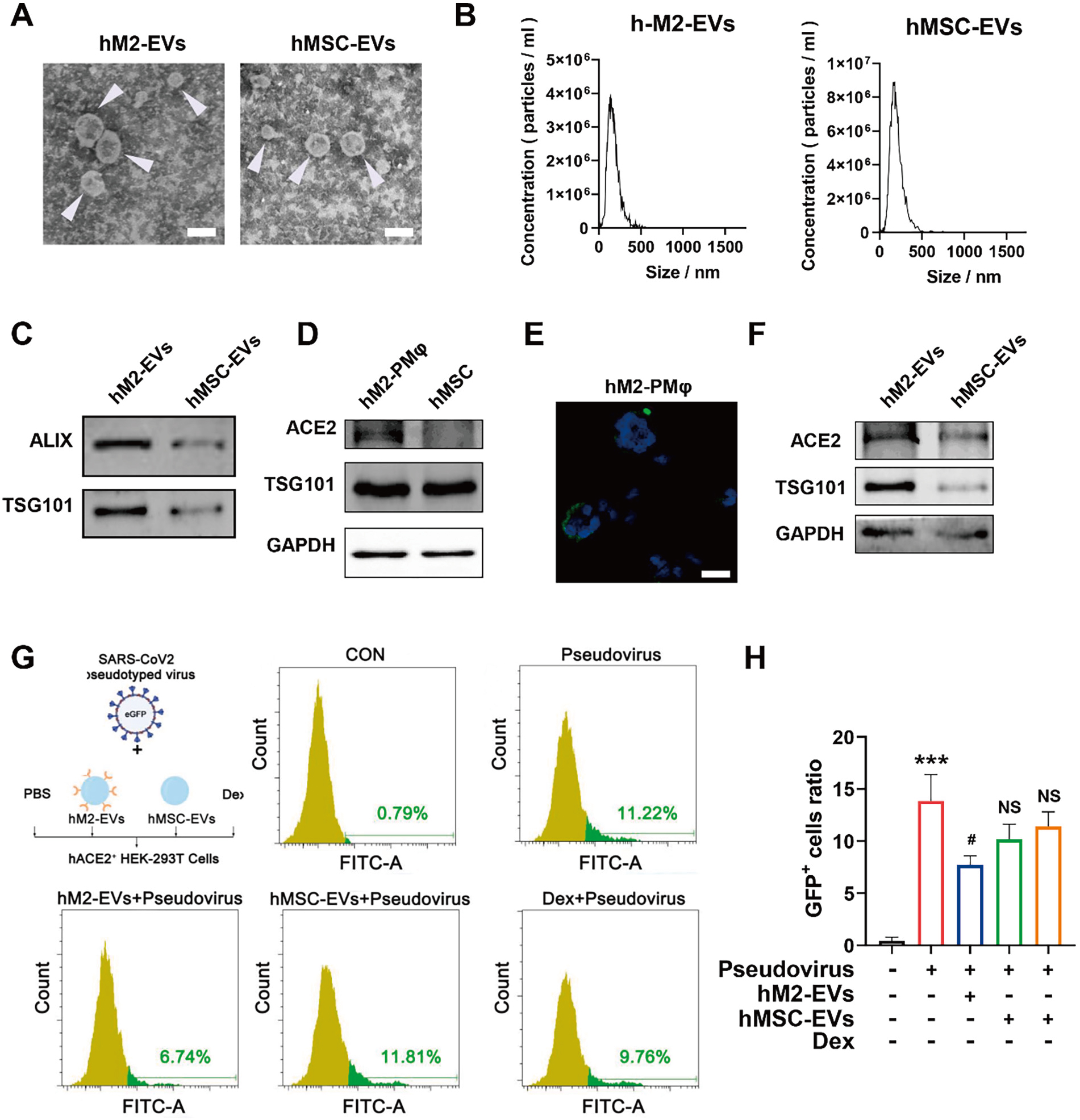
图6 体外研究M2-EVs的抗病毒感染作用
结论
本文研究报道,腹腔M2巨噬细胞来源的细胞外囊泡(M2-EVs)可作为潜在天然多靶点纳米药物通过递送多种活性免疫调节分子多靶点调节感染性疾病(细菌、病毒)中多条促炎反应通路的激活,用于治疗感染性疾病(细菌、病毒)所致的细胞因子风暴,减轻多器官官损伤。此外,M2-EV还可作为纳米诱饵阻断病毒(如SARS-CoV-2)对细胞的感染。
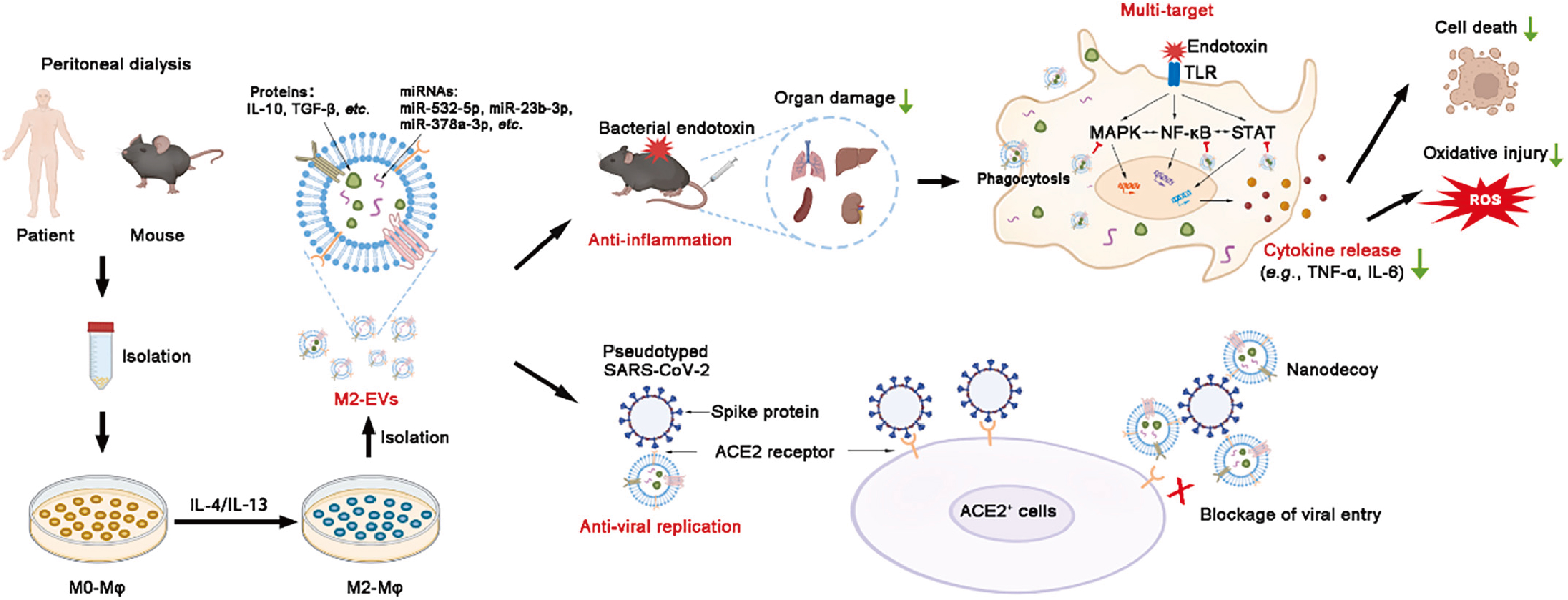
图7 本文研究结果示意图
四川大学的王一卓为文章的第一作者。
和元生物有幸为本研究提供新冠相关产品和病毒包装服务,用实际行动助力科学研究!
参考文献:
[1] B. Allegranzi, S. Bagheri Nejad, C.Combescure, W. Graafmans, H. Attar,L.Donaldson, D. Pittet, Burden of endemic health-care-associated infection in developing countries: systematic review and meta-analysis, Lancet 377 (9761)(2011) 228–241.
[2] R. Karki, T.D. Kanneganti, The ’cytokine storm’: molecular mechanisms and therapeutic prospects, Trends Immunol. 42 (8) (2021) 681–705.
[3] F. Coperchini, L. Chiovato, L. Croce, F. Magri, M. Rotondi, The cytokine storm in COVID-19: An overview of the involvement of the chemokine/chemokine-receptor system, Cytokine Growth Factor Rev. 53 (2020) 25–32.
[4] Y. Guo, T. Li, X. Xia, B. Su, H. Li, Y. Feng, J. Han, X. Wang, L. Jia, Z. Bao, J. Li,Y. Liu, L. Li, Different profiles of antibodies and cytokines were found between severe and moderate COVID-19 patients, Front. Immunol. 12 (2021), 723585.
[5] Y. Wang, M. Zhao, S. Liu, J. Guo, Y. Lu, J. Cheng, J. Liu, Macrophage-derived extracellular vesicles: diverse mediators of pathology and therapeutics in multiple diseases, Cell Death Dis. 11 (10) (2020) 924.
[6] Yizhuo Wang,et al. Peritoneal M2 macrophage-derived extracellular vesicles as natural multitarget nanotherapeutics to attenuate cytokine storms after severe infections,J Control Release.2022 Jul 6;349:118-132.doi: 10.1016/j.jconrel.2022.06.063.
业务咨询

