上期文章Cell Metabolism | 氨基酸如何支持免疫(上)从以下几个方面进行了总结:(1)不同免疫细胞如何选择性地获取氨基酸;(2)氨基酸如何支持对免疫细胞激活至关重要的代谢重编程;(3)氨基酸作为免疫细胞内氧化还原平衡的中心调节因子如何影响免疫细胞的代谢和翻译活性。本期继续探讨氨基酸如何通过提供中间体来调节免疫效应蛋白的活性、急性免疫反应和免疫细胞记忆,以及免疫细胞与肿瘤细胞之间的氨基酸竞争,通过靶向氨基酸代谢如何调节癌症、感染和自身免疫中的免疫反应。
氨基酸支持核酸和蛋白质修饰
氨基酸为甲基化提供甲基。蛋氨酸除了对硫代谢具有重要作用外,还为蛋白质和核苷酸的甲基化提供甲基来调节它们的功能(图2和3)。组蛋白和DNA甲基化可以通过改变DNA对转录复合物的可及性来促进或抑制转录,T细胞激活时抑制(H3K27)和激活(H3K4)组蛋白甲基化均是转录重构的基础。腺苷甲基化控制mRNA稳定性对T细胞稳态具有重要意义,缺乏N6-甲基腺苷甲基化(m6A) RNA的T细胞不会扩增和分化。蛋氨酸通过产生SAM来提供甲基基团,SAM是DNA、RNA和蛋白质甲基转移酶的甲基供体,甲基转移酶将甲基基团从SAM转移至底物,产生SAH和甲基化底物(图2)。然后,SAH水解酶将SAH代谢为同型半胱氨酸(Hcy),Hcy可进一步生成半胱氨酸。蛋氨酸饥饿或蛋氨酸循环抑制的Th17细胞在Il17a启动子上H3K4甲基化降低且IL-17分泌减少,而蛋氨酸饥饿的Th1细胞产生更少的IFN-γ。此外,膳食蛋氨酸限制导致EAE小鼠产IL-17和IFN-γ的细胞减少,延缓疾病的发生并降低了其严重程度。除了对免疫细胞功能的急性影响,蛋氨酸还可通过表观遗传修饰免疫细胞记忆而产生更持久的影响。
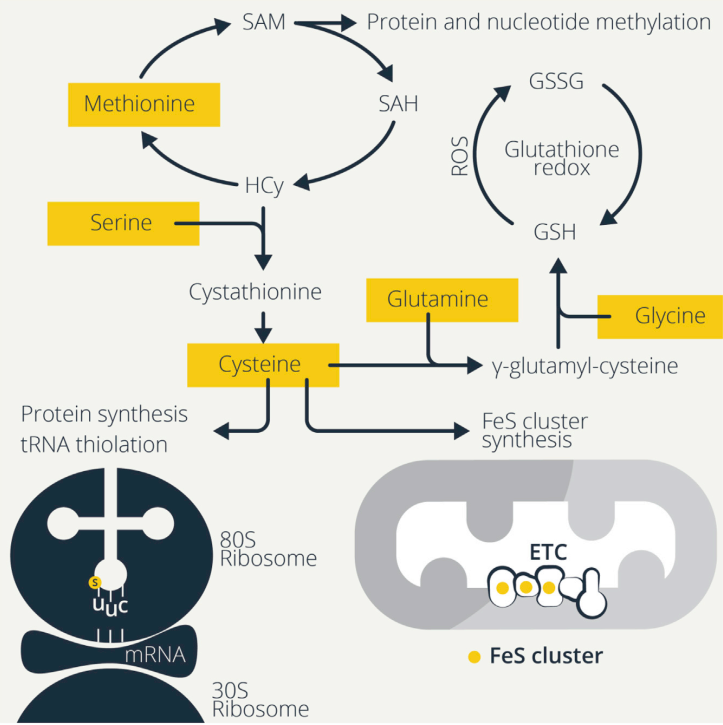
Figure 2. Sulfurous Amino Acids Maintain Redox Balance and Drive Protein Synthesis
基于蛋氨酸转运的T细胞激活。抗原刺激的T细胞增加并维持蛋氨酸转运到细胞中,这是激活T细胞中甲基供体供应和甲基化目标分子的限速步骤。蛋氨酸转运体的表达仅限于活化的T细胞,即使未成熟T细胞具有蛋氨酸代谢酶,也不能将足够的蛋氨酸转运到细胞中来增加蛋白质合成。因此,控制细胞蛋氨酸水平调控T细胞状态。只有能增加蛋氨酸转运的T细胞才有足够的蛋氨酸来驱动甲基化、蛋白质合成和增殖。Slc7a5是激活T细胞中主要的蛋氨酸转运体,对T细胞分化具有重要影响。TCR刺激促进蛋氨酸循环通量,增加SAH和Hcy的产生,并且蛋氨酸缺失时激活CD4+T细胞有增殖缺陷,但激活标志正常表达,产生IFN-γ的细胞频率较低。蛋氨酸限制通过减弱Myc诱导来限制T细胞活化,这是T细胞活化的关键。
精氨酸促进多胺代谢。甲基化不是唯一受氨基酸供应调控的PTM(图3)。精氨酸代谢也会导致蛋白结构修饰从而影响免疫细胞功能。精氨酸酶I将精氨酸代谢为鸟氨酸,而鸟氨酸供应多胺合成,包括亚精胺的产生。亚精胺被用来合成非常规的氨基酸hypusine,它在翻译后只修饰一个已知的靶点,真核翻译起始因子5a(eIF5a),驱动翻译延伸和终止。小鼠M1样巨噬细胞通过诱导型NO合酶(iNOS)代谢精氨酸产生瓜氨酸和NO,抑制OXPHOS,导致糖酵解增加并支持促炎巨噬细胞功能,包括细胞因子的产生。多胺的产生支持M2样巨噬细胞的功能,同时限制M1样巨噬细胞的炎症活性。
巨噬细胞从凋亡细胞中摄取精氨酸,通过精氨酸酶I代谢,并以腐胺依赖的方式激活肌动蛋白调节蛋白Rac1,使凋亡细胞进一步内化,确保巨噬细胞的代谢物供应。髓源性抑制细胞(MDSCs)还通过精氨酸酶增加精氨酸代谢,限制精氨酸对T细胞的供应,并以类似的方式抑制NK细胞功能和IFN-γ的产生。精氨酸缺乏的NK细胞活力、NK细胞激活受体NKp46和NKp30的表达以及IFN-γ降低。精氨酸驱动代谢向氧消耗转变,增加活化的T细胞的备用呼吸功能,并支持CD4+T和CD8+T细胞存活。多胺替代部分挽救了谷氨酰胺剥夺对T细胞活化的不利影响,表明谷氨酰胺的一个用途可能是代谢为精氨酸以合成多胺。亚精胺还具有抗衰老作用,可能是由于其增强免疫细胞的功能。亚精胺随着年龄的增长而减少,膳食补充或增强肠道菌群合成亚精胺可能通过维持免疫细胞活性而有助于延长寿命。
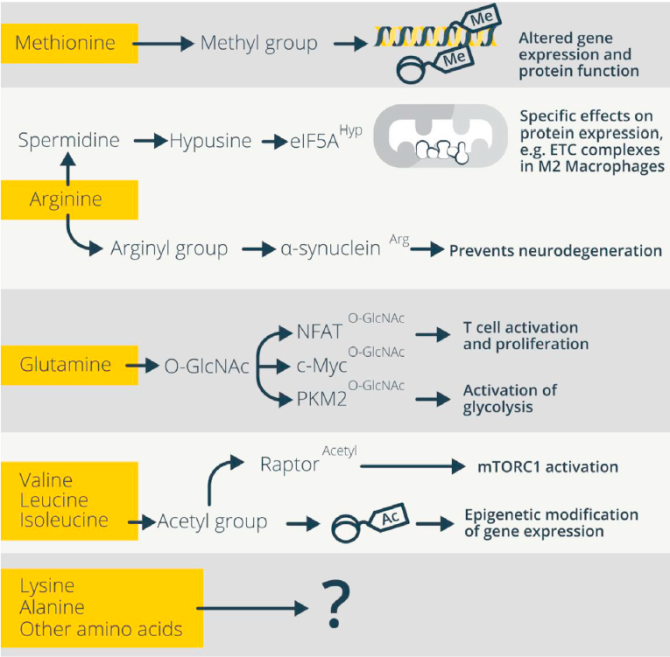
Figure 3. Amino Acids Influence Cell Function by Supplying Intermediates for Protein and Nucleotide Modifications
谷氨酰胺为己糖胺生物合成途径提供燃料。己糖胺生物合成途径(HBP)将谷氨酰胺代谢为尿苷二磷酸N-乙酰-氨基葡萄糖(UDP-GlcNAc)。谷氨酰胺饥饿或谷氨酰胺分解增加限制了谷氨酰胺对HBP的供应,降低细胞内UDP-GlcNAc水平,从而影响T细胞的功能。HBP和N-连接糖基化通量也调节Th17细胞分化。Th17细胞中,高糖酵解和谷氨酰胺分解限制了HBP活性,从而限制N-聚糖的分支并促进 Th17细胞的产生。谷氨酰胺或 GlcNAC的补充,或谷氨酰胺分解的抑制,逆转了这些效应,阻碍了Th17细胞的产生,同时促进了Treg细胞的分化。
TCR刺激和c-Myc激活促进CD4+T细胞的O-GlcNAc糖基化,这需要增加谷氨酰胺的摄取来增加UDP-GlcNAc的供应,通过这种修饰,NFAT和c-Myc本身被激活和稳定。胸腺T细胞自我更新、T细胞激活和扩增以及新生RNA合成、IL-2产生和原代人T细胞增殖需要O-GlcNAc转移酶(OGT)。PKM2的O-GlcNAc糖基化促进了白血病细胞和实体瘤的核易位和糖酵解的激活。谷氨酰胺、甘氨酸以及半胱氨酸也可用于S-谷胱甘肽化修饰,在靶蛋白中加入谷胱甘肽三肽。但这种修饰是否以及如何在免疫细胞中发挥作用目前尚不清楚。总的来说,TCR刺激可以增加UDP-GlcNAc的产生,这本身就需要增加谷氨酰胺的供应,再次突出了谷氨酰胺运输是调控T细胞功能的控制点。
BCAAs支持乙酰化。BCAA代谢提供用于乙酰化的乙酰CoA衍生物。HeLa细胞中亮氨酸衍生的乙酰CoA通过EP300乙酰转移酶乙酰化mTORC1调节因子Raptor。一般来说,组蛋白乙酰化使染色质更容易进入转录复合物,并与转录增加有关,而组蛋白去乙酰化与转录抑制有关。H3K27乙酰化的广泛改变伴随着巨噬细胞的分化,并且组蛋白乙酰化的差异有助于诱导天然免疫耐受(对再刺激的反应性降低)或训练(对再刺激的反应性增加)。参与糖酵解和mTOR信号转导的基因在人原代单核细胞的β-葡聚糖训练中表现出改变的乙酰化模式。调节HDAC活性和启动子乙酰化可正向和负向调节炎症基因的表达。
非组蛋白乙酰化也会影响免疫细胞功能。中枢促炎转录因子核因子(NF) kB的活性需要其乙酰化,NLRP3蛋白乙酰化促进炎症小体的激活。乙酰化可能是伴随免疫细胞激活的代谢开关的基础,因为大多数糖酵解和TCA循环酶都可以乙酰化,从而影响酶的功能。例如记忆CD8+T细胞中3-磷酸甘油醛脱氢酶乙酰化增强了自身的活性,增加糖酵解以支持迅速的召回反应和细胞因子产生。这些记忆CD8+T细胞增加乙酸摄取,以扩大其乙酰CoA池,以支持这种增加的乙酰化,但增加BCAA供应可能具有同样的效果。相反,由HDACs介导的去乙酰化可以抗炎,因此限制BCAAs的乙酰化供应可以达到类似的结果。
氨基酸用于免疫细胞核苷酸合成
细胞分裂和转录过程中需要核苷酸来合成DNA和RNA,嘌呤和嘧啶核苷酸通过细胞周期促进活化的T细胞进程,Myc增加核苷酸合成基因的表达。天冬氨酸和谷氨酰胺为嘧啶环的形成提供碳骨架,而来自丝氨酸-甘氨酸代谢的甘氨酸和四氢叶酸(THF)为嘌呤的合成提供碳。核苷酸可以部分挽救谷氨酰胺剥夺对T细胞活化的不利影响,表明谷氨酰胺在免疫细胞活化中可以提供核苷酸。
CD8+ Teff细胞激活增加了丝氨酸、甘氨酸、一碳(SGOC)网络组分的表达,并且丝氨酸限制抑制T细胞增殖,但不抑制活化标志物CD69、CD25和CD44或IFN-γ的产生。这些T细胞需要胞外丝氨酸来支持嘌呤核苷酸的产生,为丝氨酸缺乏的T细胞提供甲酸和甘氨酸足以恢复嘌呤生物合成和T细胞增殖,丝氨酸是1-C途径的主要碳来源。有研究报道甘氨酸通过在质膜中打开甘氨酸门控通道来降低细胞内钙水平从而对T细胞也有抗增殖作用。
核苷酸合成也需要天冬氨酸。ETC活性抑制的Jurkat细胞降低了天冬氨酸的合成,从而减缓了这些细胞的增殖。胞质天冬氨酸氨基转移酶GOT1将天冬氨酸转氨为谷氨酸从而将还原当量转移到线粒体基质,但在ETC被抑制时,反向产生天冬氨酸,部分补偿线粒体天冬氨酸合成的损失,这种逆转作用支持ETC抑制的Jurkat细胞的增殖。线粒体代谢还通过提供电子受体(如O2)来支持天冬氨酸的合成。谷氨酰胺合成天冬氨酸需要线粒体代谢产生的电子受体。在没有这种电子受体的情况下,天冬氨酸的合成和核苷酸的产生降低。
免疫细胞与癌细胞竞争氨基酸
所有细胞都需要氨基酸来合成蛋白质和发挥功能,但免疫细胞状态的迅速和急剧变化对氨基酸的要求非常特殊。限制氨基酸供应会损害免疫细胞功能,这种情况可能发生在致瘤环境中,以限制抗肿瘤免疫。癌细胞具有较高的代谢需求,可以与免疫细胞竞争氨基酸资源(图4)。
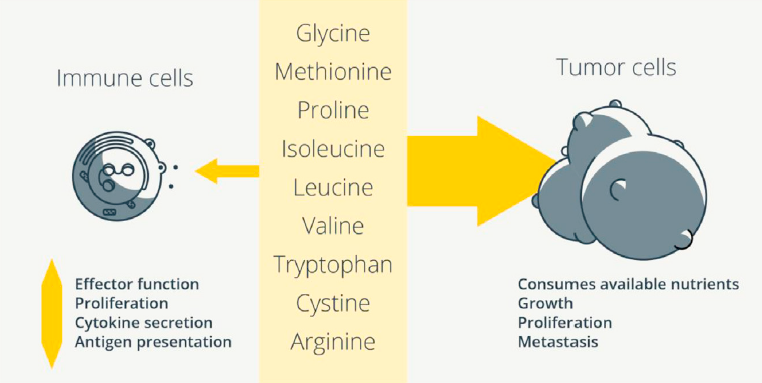
Figure 4. Do Immune Cells and Tumor Cells Compete for Amino Acids in the Tumor Microenvironment?
肿瘤细胞具有不同的氨基酸需求。与T细胞一样,肿瘤细胞从外界摄取氨基酸依赖于谷氨酰胺的摄入。甘氨酸通过Shmt2促进丝氨酸-甘氨酸交换,甘氨酸消耗与癌细胞增殖有关。Shmt2活性的增加驱动丝氨酸代谢,通过供应核苷酸支持癌细胞增殖。癌细胞确实会增加SGOC网络的活性,其中丝氨酸被代谢为甘氨酸,并产生5,10-亚甲基四氢叶酸,为核苷酸合成提供1-C。肿瘤初始细胞增加了蛋氨酸循环活性和转甲基化速率,使这些细胞依赖于胞外蛋氨酸的摄入。抑制蛋氨酸代谢或限制胞外蛋氨酸可促进癌细胞死亡。脯氨酸代谢支持转移形成,乳腺癌细胞摄取丙酮酸也是如此。乳腺癌细胞利用这种代谢物驱动胶原羟化重塑细胞外基质,促进转移。这种胶原修饰依赖于丙酮酸代谢为αKG,同时分泌丙氨酸,这可以驱动未成熟T细胞的初始激活和Tmem细胞的再刺激。另一方面,丙酮酸还能增加巨噬细胞中免疫检查点受体配体PD-L1的表达。癌细胞摄取的丙酮酸是否用于增加PD-L1的表达并抑制抗肿瘤反应值得探究。通过BCAT1增加BCAA分解代谢促进胶质母细胞瘤的生长,可能是通过促进产能的代谢途径,但肝细胞癌的进展与BCAT1介导的BCAA分解代谢减少有关。这保留了BCAAs来激活mTOR。因此,重要的是要描述不同癌症类型的氨基酸需求。
由于肿瘤细胞和各种肿瘤相关免疫细胞的氨基酸代谢,肿瘤微环境中氨基酸供应的改变可能具有促进和抗肿瘤的作用。例如,剥夺Treg细胞中的氨基酸可以消除其对Teff功能的抑制作用,从而促进Teff细胞的抗癌活性。刺激TCR可增加Treg细胞中氨基酸转运体的表达,精氨酸和亮氨酸通过小G蛋白RagA/B和 Rheb1/2促进Treg细胞mTORC1的活性。这种信号驱动Treg细胞的抑制活性,包括诱导性T细胞共刺激因子(ICOS)和CTLA4的表达。B16黑色素瘤模型中,RagA缺乏会损害Treg细胞在肿瘤中的增殖和积累,使肿瘤浸润的CD8+T细胞随着颗粒酶B水平的增加而扩张,增强抗肿瘤免疫。
肿瘤微环境中哪些细胞类型摄取氨基酸,以及转运蛋白谱和拷贝数是否不同有待进一步研究。谷氨酸对T细胞的不同影响依赖于转运体的表达。Gls1在许多癌症中过表达,这可能会增加谷氨酸的水平。乳腺癌细胞、巨噬细胞和DCs分泌的谷氨酸经常渗入肿瘤。未成熟T细胞表达谷氨酸转运体mGlu5R,抑制TCR介导的激活和增殖,而活化的T细胞表达另一种谷氨酸转运体mGlu1R,通过MEK-ERK1/2抑制mGlu5R的抗增殖活性,促进增殖以及IL-2和IFN-γ的产生。这两种转运体的平衡决定谷氨酸是具有促进还是抗肿瘤作用。B细胞和DCs也表达谷氨酸受体,使其功能受到谷氨酸的调节。谷氨酸信号通过kainate受体,以增加激活B细胞产生的免疫球蛋白。未来的研究需要为肿瘤和免疫细胞之间对氨基酸的竞争提供直接证据,以及这如何最终调节癌症的保护性免疫。
抗肿瘤免疫中的色氨酸和精氨酸。色氨酸代谢酶吲哚胺-2,3-双加氧酶1(IDO-1)抑制剂可针对多种癌症起作用。IDO-1将色氨酸分解代谢为犬尿氨酸,在癌细胞和激活的免疫细胞中其表达均增加。T细胞的增殖和激活需要色氨酸,利用IDO-1抑制剂针对癌细胞也可能通过限制色氨酸代谢抑制T细胞介导的免疫。因此,将IDO-1抑制剂特异性靶向癌细胞至关重要。肿瘤细胞中IDO的过表达也会损害T细胞的反应,可能是通过驱动癌细胞中的色氨酸降解和限制T细胞的色氨酸供应。犬尿氨酸的增加可调节T细胞反应,诱导细胞凋亡,降低TCR表达,并促进Treg细胞分化。犬尿氨酸也会抑制NK细胞增殖和细胞因子的产生。
肿瘤相关的pDCs在肿瘤引流淋巴结中积累,并通过IDO引起抗原特异性T细胞失能。肿瘤相关DCs还消耗精氨酸,限制T细胞对它的利用,而DCs将亚精胺代谢为精氨酸进一步推动IDO的表达。这与T细胞中亚精胺的产生形成了鲜明的对比,从而增强了它们的抗肿瘤作用。总的来说,DCs的这些作用限制了T细胞的抗肿瘤免疫。MDSCs抑制CD8+T细胞功能是通过靶向胞内精氨酸而不是精氨酸的摄取。最近一项研究表明,MDSCs将甘氨酸衍生的代谢物甲基乙二醛转移到CD8+T细胞,与精氨酸形成糖基化产物,从而消耗CD8+T细胞激活所需的胞内精氨酸。
精氨酸缺失也会阻碍IFN-γ的产生和人NK细胞增殖。表达精氨酸酶的肿瘤相关巨噬细胞(TAMS)与促肿瘤生长有关,而低精氨酸酶表达的TAMS通过促进巨噬细胞和NK细胞介导的抗肿瘤免疫而驱动肿瘤缩小。抑制免疫细胞直接靶向胞内精氨酸代谢和限制胞外精氨酸供应限制抗肿瘤T细胞免疫,表明免疫细胞如何通过肿瘤环境中的氨基酸代谢相互调节。
半胱氨酸在癌症免疫治疗中的调节作用。肿瘤细胞对铁死亡特别敏感,肿瘤免疫治疗中,CD8+T细胞激活肿瘤中的铁死亡,驱动脂质过氧化和肿瘤细胞死亡。这些T细胞中的IFN-γ降低了肿瘤细胞的谷氨酸-胱氨酸逆向转运系统XC-的成分Slc3a2 和 Slc7a11。这限制了肿瘤细胞摄取胱氨酸,减弱了它们拮抗铁死亡的能力。胱氨酸和半胱氨酸耗竭结合检查点阻断协同增强T细胞抗肿瘤免疫。MDSCs可能通过限制半胱氨酸对T细胞的有效性来限制T细胞的激活,DCs也是如此。这种影响可能部分是由于GSH合成的限制和细胞外氧化还原状态的改变。
靶向氨基酸代谢用于抗癌治疗。癌细胞对氨基酸摄取和代谢的依赖意味着特定靶向相关细胞类型中的这些过程可能作为癌症治疗的手段。比如,优先被肿瘤微环境中的酶激活的谷氨酰胺拮抗剂的前药形式,降低了体内MC38结肠肿瘤的糖酵解和OXPHOS,但在CD8+T肿瘤浸润淋巴细胞(TILs)中促进了这些反应。TILS,而非MC38肿瘤细胞,能够通过增加糖酵解代谢物进入TCA循环的通量来补偿谷氨酰胺代谢的下降,这增强了抗肿瘤免疫。此外,调节精氨酸的供应也可以限制抗肿瘤T细胞的活性。
癌细胞和肿瘤相关免疫细胞上不同的转运体表达可能有助于氨基酸代谢的特异性靶向。癌细胞上特定转运体表达的增加被可用于针对这些细胞的药物,也可能意味着肿瘤细胞对某些氨基酸的依赖增加。氨基酸转运体也可以被操纵,特异性地将具有氨基酸片段或氨基酸样结构的药物传递给肿瘤细胞。
暴露于高氧化应激的癌症使用氨基酸来产生抗氧化分子。具有核因子红血球2相关因子(Nrf)2/Kelch样ECH相关蛋白(Keap)1突变的肺腺癌高度依赖于外源性非必需氨基酸,缺乏天冬酰胺或丝氨酸和甘氨酸的饮食可减少Keap1突变型肿瘤的生长。这意味着饮食干预是潜在的抗癌策略。
小结
氨基酸在许多方面影响免疫细胞功能,而不仅仅是为蛋白质合成提供材料。它们在中枢能量代谢、氧化还原平衡、表观遗传修饰和PTMs中的作用使它们能够通过多种机制调节免疫(图5),从而为治疗干预提供了多种靶点。氨基酸转运体是很好的潜在药物靶点,饮食干预也可能有类似的效果,这两种策略都可能有利于治疗癌症和其他疾病。不同免疫细胞对氨基酸扰动的反应可能不同,这取决于它们是否表达转运体和胞内代谢酶来处理这些氨基酸。不同组织和部位含有不同的氨基酸储备。氨基酸也可以小肽的形式储存,如谷胱甘肽,然后可以分解代谢释放半胱氨酸、谷氨酸和甘氨酸,反过来可以代谢产生其他氨基酸。总之,靶向免疫细胞氨基酸代谢是增强或拮抗免疫反应的有效手段,增强对免疫细胞氨基酸代谢的认识可能具有很大的治疗价值。

Figure 5. Amino Acids Support Immune Cell Function by Multiple Mechanisms
参考文献
Kelly and Pearce, Amino Assets: How Amino Acids Support Immunity. Cell Metabolism (2020). https://doi.org/10.1016/j.cmet.2020.06.010.
原文阅读,请长按识别下方二维码

精彩推荐
2. Cell Metabolism | 氨基酸如何支持免疫(上)
3. Geroscience︱代谢组-微生物组-免疫因子关联分析揭示大鼠机体随年龄变化规律
4. Nature Reviews Clinical Oncology | 代谢调节提高免疫治疗
5. Immunity | 重磅综述: 饮食-菌群-免疫互作
6. TEM | 宿主与菌群互作的信号分子--AAA相关菌群代谢物
7. Cell子刊 | 癌细胞并不孤单--肿瘤微环境中的代谢通信

