通过免疫检查点抑制剂(ICI)治疗重新激活抗肿瘤免疫是当前肿瘤治疗的关键,在一些肿瘤患者中疗效显著。虽然阻断抑制性T细胞受体,如程序性细胞死亡-1 (PD-1)或其配体PD-L1,能激活抗肿瘤T细胞反应并显示出强大的临床疗效,但只有40%的黑色素瘤患者对治疗有反应。研究表明,共生菌可以影响宿主的抗肿瘤免疫;最近的几项研究也发现益生菌补充剂和黑色素瘤患者免疫治疗反应之间的联系。然而对于益生菌对肿瘤患者ICI反应性的影响,以及驱动这些影响的机制尚不清楚。来自美国匹兹堡大学Marlies Meisel团队揭示了在肿瘤微环境中,益生菌释放的芳基烃受体(AhR)激动剂吲哚-3-甲醛(I3A)和CD8+T细胞之间的菌群-宿主相互作用,可有效增强抗肿瘤免疫并促进ICI效果,相关研究成果发表于Cell。

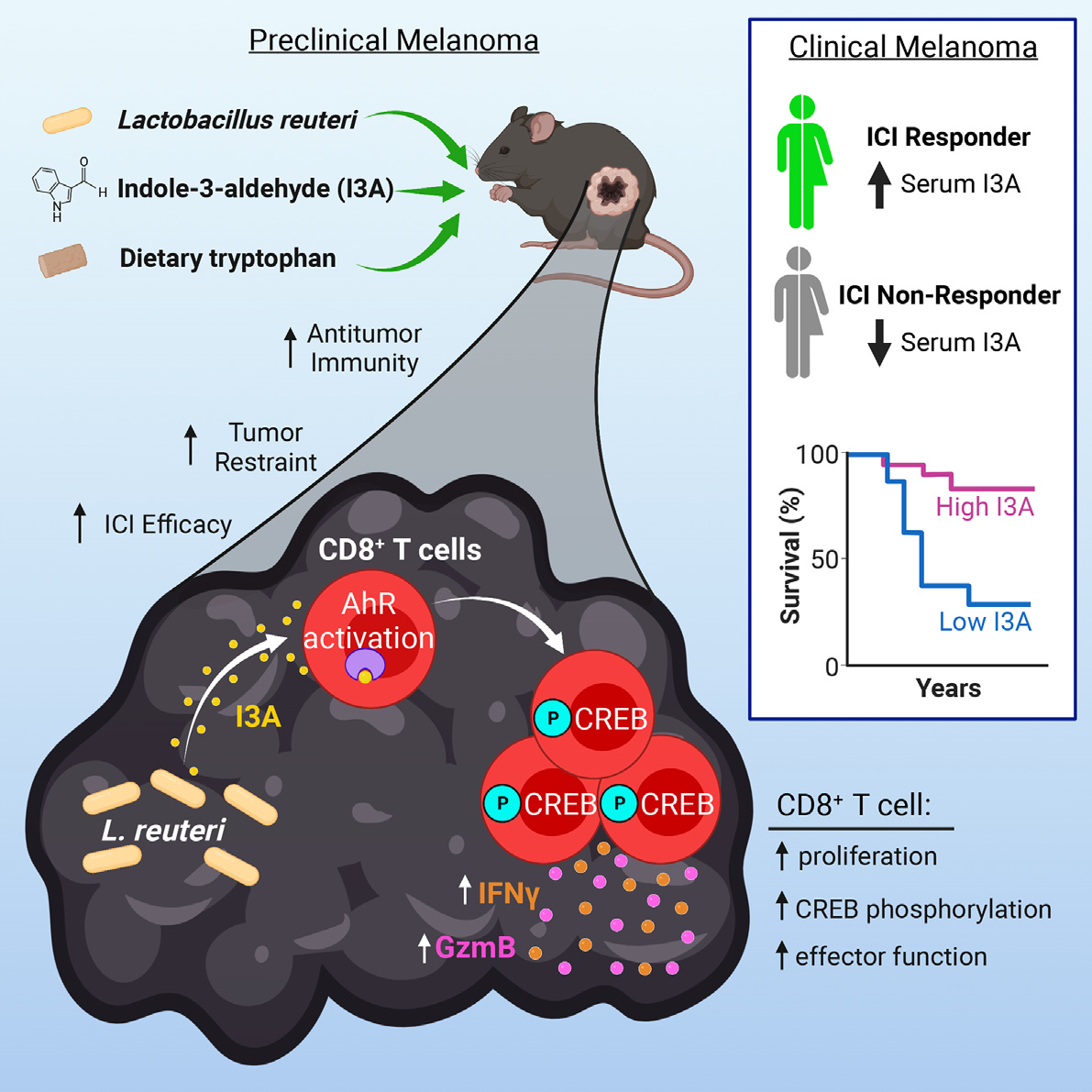
Lr诱导抗肿瘤免疫并促进临床前黑色素瘤的ICI
选择长双歧杆菌(Bl)、罗伊氏乳杆菌(Lr)、约氏乳杆菌(Lj)和大肠杆菌(Ec)四种常用益生菌,加入到临床前黑色素瘤模型的无菌小鼠的日常饮食中,以测试其抗肿瘤潜力。结果显示,在肿瘤细胞移植(TCE)后1天开始每天口服Bl、Ec或Lr,可有效抑制黑色素瘤的生长,且生存率增加。而Lj未能介导肿瘤抑制,表明共生体抑制肿瘤生长的能力是特定物种的。且Lr是模型中具有最强肿瘤抑制能力的益生菌。通过流式细胞仪对早期(TCE后第9天[pTCE])、中期(TCE后第11天)和晚期(TCE后第17天)的免疫反应进行分析,评估Lr治疗在整个肿瘤发展过程中的全身免疫调节效果。结果显示,在评估的所有时间点,Lr治疗使肿瘤微环境(TME)向抗肿瘤性、免疫刺激性环境倾斜,其特点是产生干扰素γ(IFNγ)的Th1细胞(IFNγ+CD8 T细胞)和Tc1细胞(IFNγ+CD8 T细胞)的扩张,总之,Lr能有效地增强抗肿瘤免疫(图1)。

图1. Lr诱导抗肿瘤免疫并促进临床前黑色素瘤的ICI
瘤内Lr是介导抗肿瘤作用的必要和充分条件
在肠道肿瘤中存在肿瘤微生物组,并且已经从乳腺和胰腺患者的肿瘤中找到了活的细菌。然而,瘤内菌是否是影响肿瘤发展的主动媒介尚不清楚。为此,在Lr选择性培养基中培养肿瘤匀浆物,并在服用Lr的小鼠的所有肿瘤中均检测到活的Lr。为了探究Lr如何影响肿瘤微生物组的组成,采用广谱培养法模拟肿瘤微环境(TME)中的微生物分布,在有氧/厌氧培养条件下使用不同营养成分的肉汤和琼脂,使各种细菌得以恢复。虽然在对照组小鼠的肿瘤中检测到了各种活菌,但Lr处理的小鼠肿瘤显示TME中的微生物多样性在不断下降,而Lr逐渐取而代之,表明外源性Lr灌胃驱动转位并维持肿瘤微生物组。还发现Lr在GF和SPF条件下都会转位到全身组织,包括肝脏、脾脏和肠系膜淋巴结(MLNs),这意味着Lr通过血管和淋巴途径转位。在肿瘤内检测到口服的大肠杆菌Ec,但未检测到益生菌Bl,证明细菌转位到TME并不是Lr所独有的。总之, Lr转移到肠道末端肿瘤的机制不受分类学的限制,并且独立于已建立的微生物群、肿瘤形成和肠道屏障功能障碍。
瘤内(IT)注射单剂量的Lr,并分析其在肿瘤发展过程中的TME丰度,结果显示,虽然Lr没有扩大,但在Lr注射后15天内都能从肿瘤中培养出存活的Lr,证明Lr在TME内的定植是持续的;且肿瘤的密度并未随肿瘤的大小而增加;TME为Lr提供了一个可持续的生态位,肿瘤内的Lr足以促进抗肿瘤免疫;且瘤内注射Lr到已建立的肿瘤中,显著抑制肿瘤生长,提高肿瘤内Tc1的频率,并延长生存期。使用氨苄西林(AMP)和万古霉素(VAN)以评估对瘤内Lr是否是必需的。结果显示, AMP会消耗Lr;瘤内注射AMP,而非VAN,可减少瘤内Lr。与瘤内注射VAN的Lr处理小鼠相比,瘤内注射AMP的Lr处理小鼠却无显著的肿瘤抑制或生存率的改善。总之,瘤内Lr的存在是抗肿瘤的充分条件,也是促进抗肿瘤Tc1免疫、抑制肿瘤生长和提高临床前黑色素瘤生存率所必需的(图2)。
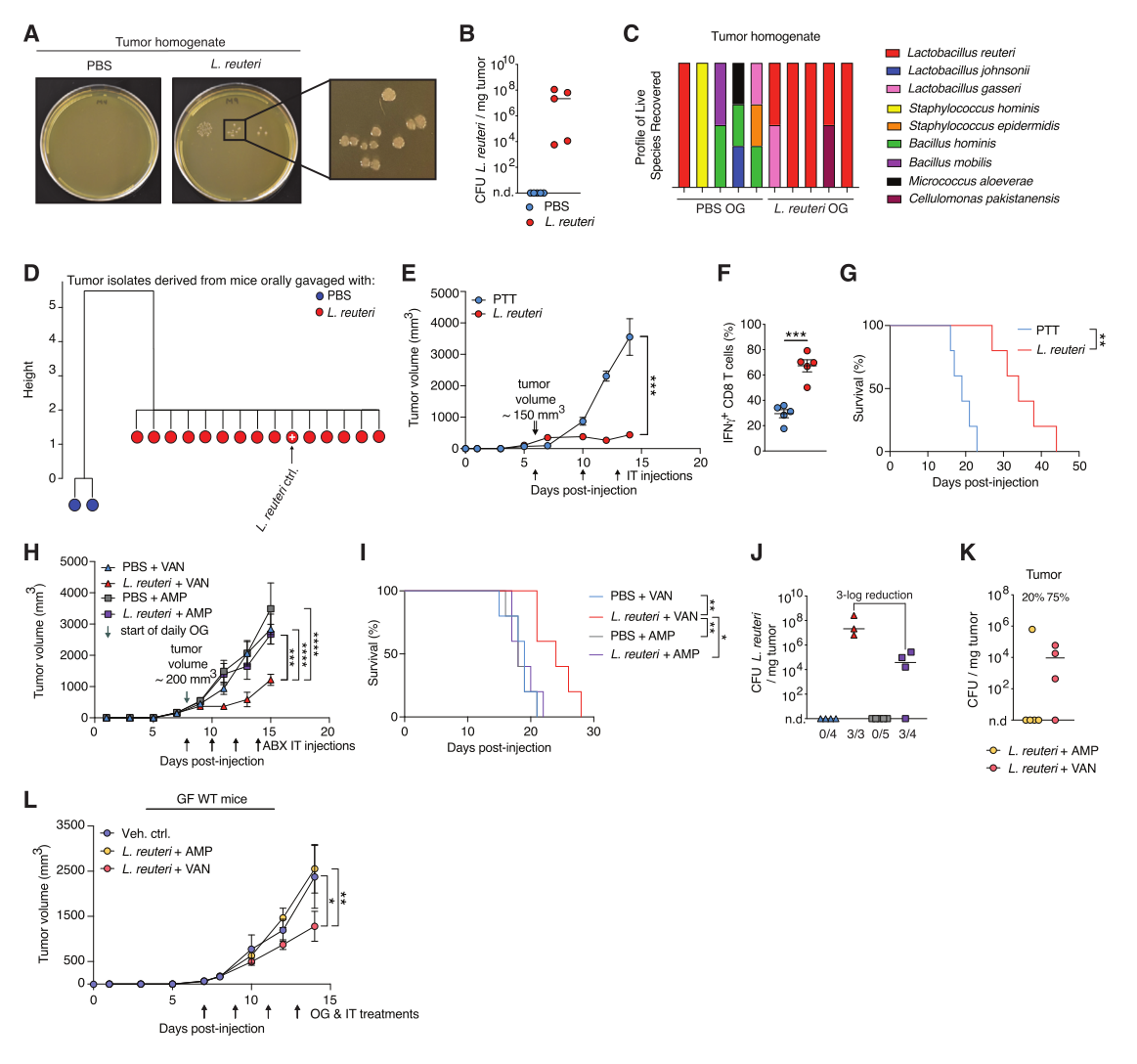
图2. 瘤内Lr是介导抗肿瘤作用的必要和充分条件
Lr释放的I3A是促进抗肿瘤免疫的必要和充分条件
用Lr分别处理YUMM1.7黑色素瘤、MC38结肠腺癌和MMTV-PyMT乳腺癌的小鼠,均显著抑制肿瘤生长,这表明Lr介导的肿瘤抑制不是黑色素瘤模型所特有的。随后用热杀的Lr进行处理,结果显示,与用活体Lr处理的小鼠相比,口服或瘤内注射热杀的Lr都不足以抑制肿瘤生长或延长生存期,这表明抗肿瘤机制可能依赖于Lr的代谢活性(图3)。
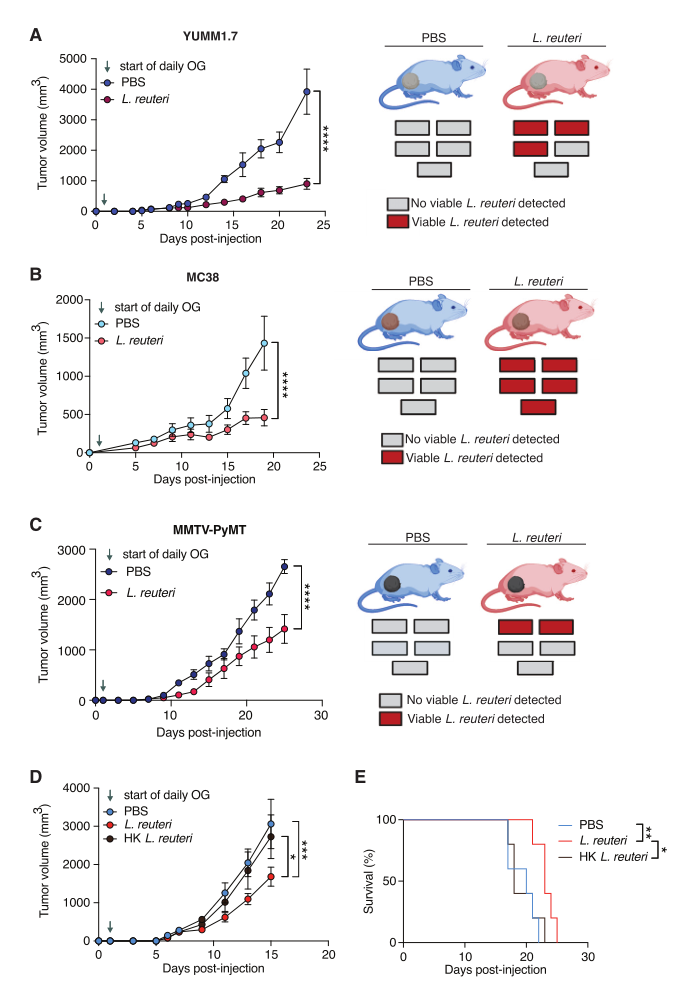
图3. 热杀的Lr不能诱导肿瘤抑制
Lr已被证明能释放几种免疫调节代谢物,其中包括吲哚衍生物I3A,它通过激活芳烃受体(AhR)(一种普遍表达的转录因子)而显示出T细胞免疫调节特性。于是探究Lr释放的I3A是否在Lr诱导的Tc1介导的抗肿瘤免疫中发挥关键作用,使用敲除芳香族氨基酸转氨酶基因(Lr ΔArAT)的转基因菌,其不能将食物中的色氨酸(Trp)分解为I3A。结果发现,与口服Lr WT不同,口服Lr ΔArAT未能抑制肿瘤生长,未能增加存活率也未能引发抗肿瘤Tc1免疫。通过培养用Lr WT或ΔArAT处理的小鼠的肿瘤,结合对肿瘤分离物的菌株特异性PCR,发现两种Lr菌株都存在,并以类似的水平存活,表明Lr ΔArAT是可以转位到肿瘤中的,其未能诱导肿瘤抑制或Tc1扩张的原因并不是其不能转位到肿瘤中。随后在富含Trp的培养基中对肿瘤来源的Lr分离物进行传代培养,结果发现,与Lr ΔArAT和对照组处理的小鼠相比,Lr WT处理的小鼠AhR活性和I3A的丰度显著增加,表明转位的Lr WT而非ΔArAT在体内将Trp分解成AhR配体I3A。
那么只有I3A是否足以诱发抗肿瘤反应呢?结果表明,口服I3A后可抑制肿瘤生长,并以剂量依赖的方式增加生存率,且I3A足以显著提高TME中Tc1的丰度和效应器功能。I3A的瘤内注射也导致显著肿瘤抑制,并以剂量依赖的方式增加存活率,表明I3A可以直接从TME内抑制肿瘤生长。且与单独使用PD-L1相比,I3A和PD-L1的组合治疗导致了肿瘤生长的显著抑制,接受组合治疗的小鼠的肿瘤重量相比对照小鼠显著下降。总之,Lr产生的I3A是抗肿瘤效应必需的,足以促进肿瘤Tc1的免疫,具有增强ICI的作用(图4)。
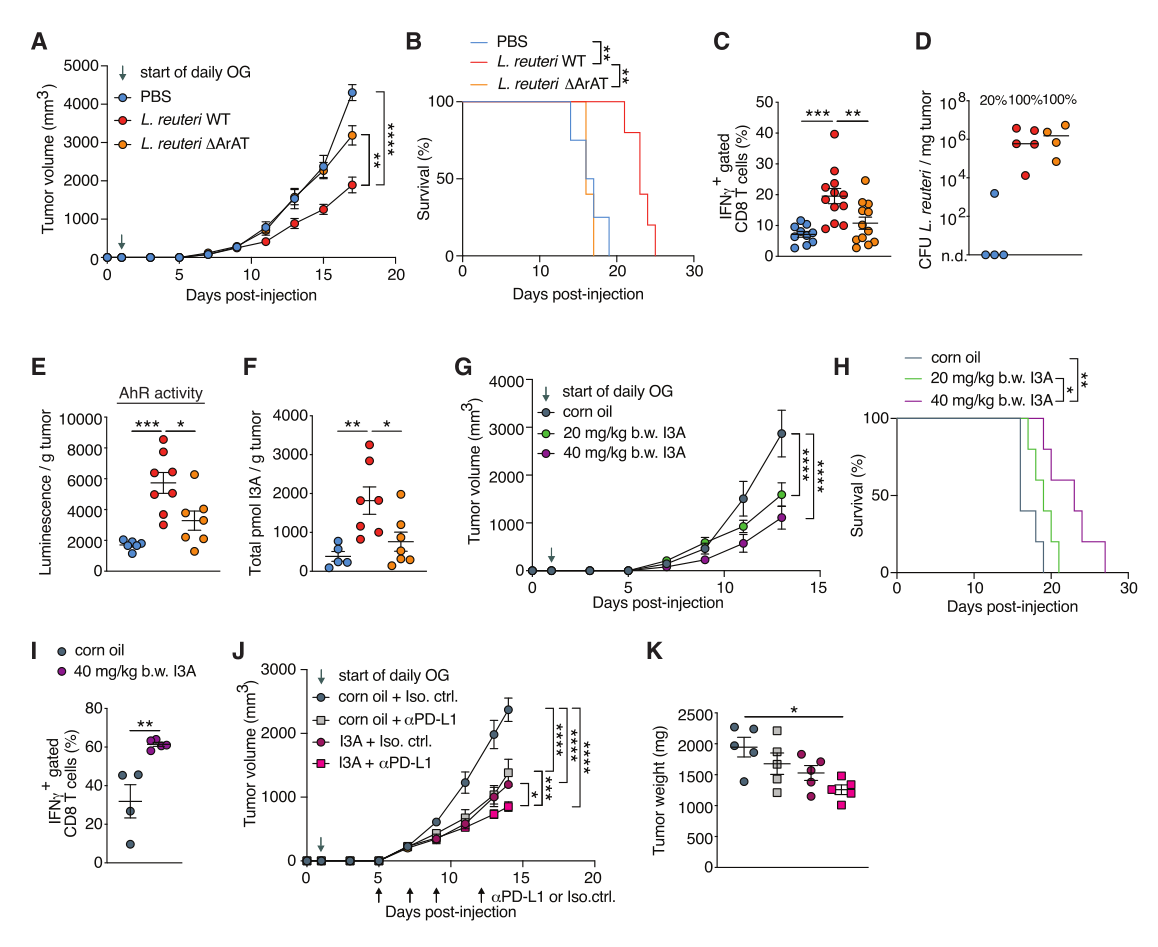
图4. Lr释放的I3A是促进抗肿瘤免疫的必要条件和充分条件
I3A通过激活CD8 T细胞内的AhR介导抗肿瘤免疫
已报道AhR激活在使CD4 T细胞分化向Th17或Treg细胞谱系倾斜方面发挥关键作用,并以配体依赖的方式进行。通过用来自LrWT或ΔArAT的上清液培养用αCD3和αCD28激活的脾脏新生CD8 T细胞,这两种细胞分别激活和不能激活AhR,观察到Lr WT-而非ΔArAT-衍生的上清液能诱导IFNγ的产生,表明Lr释放的I3A直接作用于CD8 T细胞,促进Tc1功能。转录因子富集分析显示AhR依赖性的基因富集,这些基因含有cAMP反应元件结合蛋白1(Crebp1)的转录因子结合点,其中CREB是关键的1型效应基因(如IFNγ)的重要转录激活因子,在丝氨酸133(Ser133)处进行磷酸化以激活和CREB介导的转录。结果显示,I3A刺激CD8 T细胞导致CREB(pCREB)在丝氨酸133处的磷酸化显著增加,I3A诱导关键的Tc1转录因子Blimp1和Tc1效应基因Ifng显著上调;且I3A以AhR依赖性的方式促进Tc1分化,而AhR拮抗剂则抑制I3A诱导的Tc1命运,且在AhR缺陷的CD8 T细胞中,I3A则不能诱导pCREB以及Tc1转录和T细胞效应。构建CD8 T细胞内AhR特异性缺失的小鼠(Ahrf/fCD8 Cre+),结果显示,在Ahrf/fCD8 Cre+小鼠中,Lr和I3A都不能介导的肿瘤抑制和生存益处,I3A处理未能诱导显著的Tc1反应,揭示了Lr释放的I3A介导的肿瘤抑制依赖于CD8 T细胞内的AhR激活。总之,Lr衍生的I3A以CD8 T细胞内在的、AhR依赖的方式促进Tc1分化和效应功能(图5)。
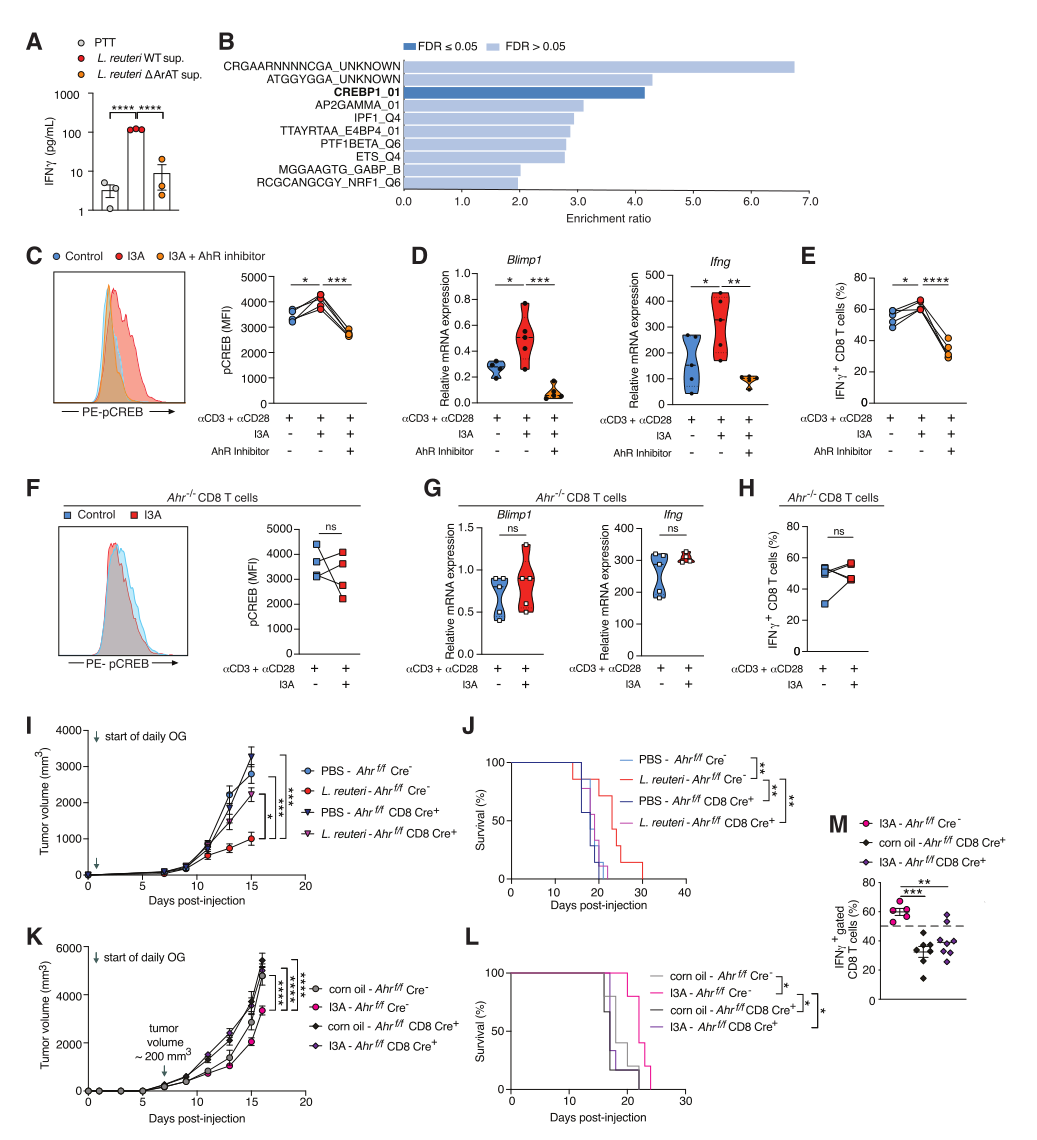
图5. I3A通过激活CD8 T细胞内的AhR介导抗肿瘤免疫
高Trp饮食促进免疫治疗
鉴于Lrc将饮食中的Trp分解成AhR配体I3A,评估饮食中的Trp水平是否影响Lr介导的抗肿瘤反应。在肿瘤细胞植入前4周,将小鼠置于高Trp或低Trp的饮食中,结果显示,与低Trp(0.19%)饮食且接受Lr的小鼠相比,高Trp(1.19%)饮食且接受Lr的小鼠呈现显著肿瘤抑制、生存率增加,表明高Trp的饮食能增强Lr介导的肿瘤抑制。且仅用高Trp的饮食(不用Lr处理)就足以抑制黑色素瘤的生长,并延长小鼠的生存期。此外,单独使用高Trp的饮食以及高Trp和Lr的组合处理的抗肿瘤效果与TME的AhR活性增加显著相关,表明高Trp的饮食通过增加TME内的AhR活性促进抗肿瘤反应。在Lr处理的情况下,高Trp的饮食导致肿瘤内I3A的显著增加。鉴于高Trp饮食的抗肿瘤作用与TME AhR活性的增加相关,评估AhR信号和CD8 T细胞内AhR活性的作用,结果显示,这两者对于Trp饮食介导的肿瘤抑制都需要。此外,单独使用高Trp的饮食显著增强PD-L1的功效。还发现高Trp的饮食足以在复杂的微生物组存在的情况下介导抗肿瘤反应,这表明除了Lr之外,其他分解Trp的细菌也可能有助于抗肿瘤免疫。总之,高Trp饮食能增强Lr的抗肿瘤作用,而在复合微生物群存在的情况下,仅高Trp饮食就能抑制肿瘤的生长并增强ICI(图6)。
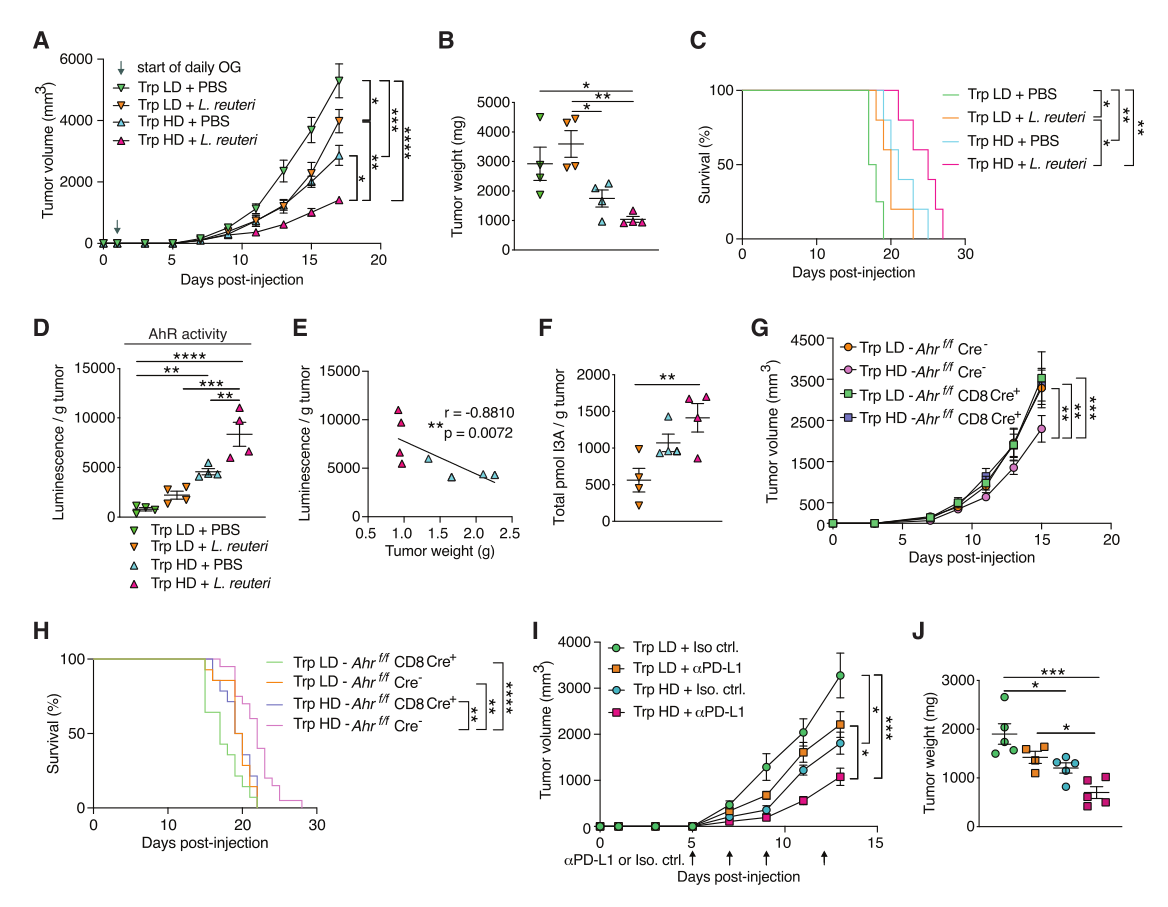
图6. 高Trp饮食抑制肿瘤的生长并增强ICI
I3A促进晚期黑色素瘤患者ICI反应和生存
纳入晚期四期黑色素瘤患者(n = 42)进行靶向代谢检测,以确定其基线I3A血清水平以研究I3A在影响人类黑色素瘤ICI疗效方面的潜在作用。将这些患者分为对IFNα和PD1组合免疫疗法有反应组(n = 19)和无反应组(n = 23)。结果显示,与无反应组相比,ICI有反应组血清中的外源性I3A浓度显著增加。将患者按血清I3A水平高(>70分位数)和低(<30分位数)分层,发现全身I3A高的患者与I3A水平低的患者相比,其无进展生存(PFS)和总生存期明显延长。
由于在晚期黑色素瘤患者中发现了另一个内源性AhR配体——Kyn的血清水平增加,并与不良预后相关,于是评估队列血清中Kyn的水平。结果表明,与I3A不同,ICI有反应组和无反应组的Kyn水平相似,且当患者按血清高Kyn和低Kyn水平分层时,PFS或总生存率无统计学差异;进一步评估Kyn在模型中的影响,发现Kyn的瘤内注射不能抑制黑色素瘤小鼠的肿瘤生长,表明通过激活AhR的肿瘤抑制是配体I3A依赖性的。总之,微生物AhR配体I3A在促进黑色素瘤患者的ICI反应方面发挥着潜在作用,有助于延长PFS和总生存期(图7)。
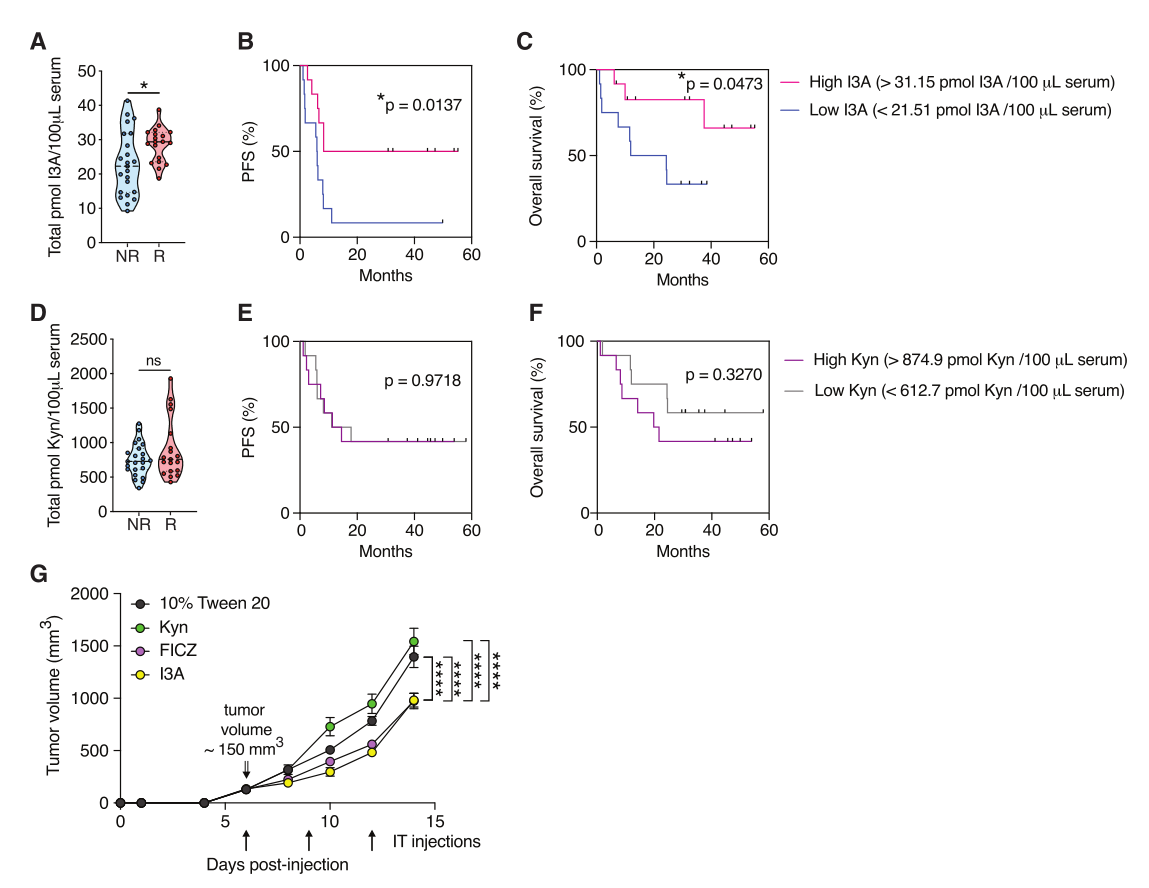
图7. I3A促进晚期黑色素瘤患者ICI反应和生存
小结
本研究发现益生菌Lr会转移到黑色素瘤内,在黑色素瘤内定植并持续存在,通过释放膳食色氨酸衍生物I3A(芳烃受体激动剂)激活CD8+T细胞的AhR通路,促进转录因子CREB磷酸化,促使其产生IFNγ,以增强ICI,抑制肿瘤大小,延长晚期黑色素瘤患者生存期,改善其预后。证实高色氨酸饮食可增强Lr和ICI诱导的抗肿瘤免疫。最后,在临床上验证了I3A促进晚期黑色素瘤患者ICI治疗反应和生存。本研究为临床试验中测试I3A治疗或益生菌和饮食结合疗法改善肿瘤免疫治疗效果提供理论依据。
参考文献
Dietary tryptophan metabolite released by intratumoral Lactobacillus reuteri facilitates immune checkpoint inhibitor treatment. Cell. 2023.
请扫描二维码阅读原文

绘谱帮你测
本研究揭示益生菌释放的I3A可有效增强抗肿瘤免疫并促进ICI效果,并在临床队列样本中利用靶向代谢检测进行验证,揭示I3A促进晚期黑色素瘤患者ICI反应和生存。本公司经典的已获得客户高度肯定的Q300全定量检测技术和升级的新品Q1000技术,均可精确捕捉到论文中提到的代谢途径中所有小分子产物的细微改变,。目前Q300技术已助力客户在Science, Cell Metabolism, Gut, Advanced Science, Diabetes Care, Nature Communications, PNAS等权威期刊发表近60篇SCI文章,平均IF>10分。
麦特绘谱专注于代谢组学与转化医学疾病研究领域,拥有成熟的代谢组学检测平台,以全定量靶向代谢组学技术为核心,包括全球独有技术Q1000、Q600、Q500、Q300、Q200和色氨酸代谢panel等各类小分子代谢物单独检测方法共20+套,兼顾非靶和广靶。同时还有菌群16S测序、宏基因组学、转录组学和蛋白质组学等多组学及联合分析等全套解决方案。独家的检测技术、全面的数据报告及专业科研级别的售后探讨,助您科研探索之路不断创新和突破。欢迎联系获取详细资料!
往期回顾
1. 客户案例 | NC二连发!代谢组学-代谢流技术助力周文教授团队在多发性骨髓瘤研究中的新突破(二)
2. 客户案例 | NC二连发!代谢组学-代谢流技术助力周文教授团队在多发性骨髓瘤研究中的新突破(一)
3. Nature | 菌群代谢物3-IAA有望大大提升胰腺癌化疗疗效!
5. 客户案例 | IF 12!上海东方医院研究团队揭示靶向肿瘤代谢重编程改善食管鳞癌顺铂耐药的新途径
6. Cell Metabolism | 肠癌免疫治疗疗效差,氨积累惹的祸!
7. Cancer Cell | 花生四烯酸与IFNγ协同诱导肿瘤铁死亡的新机制

