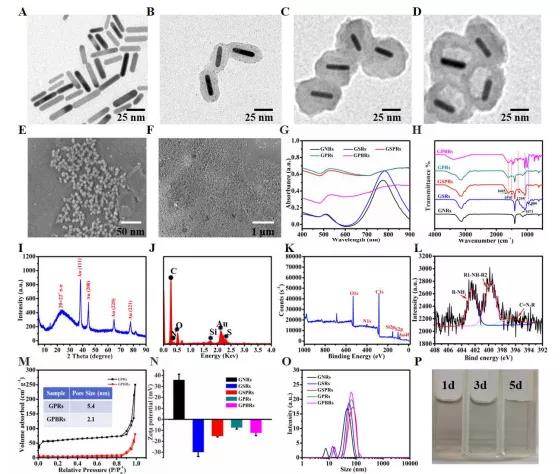
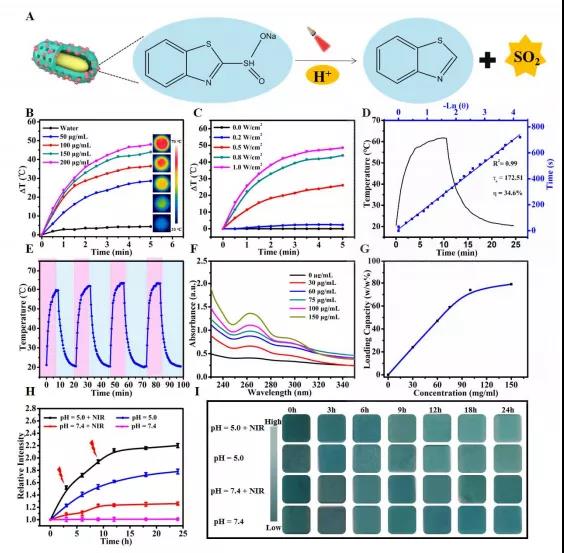
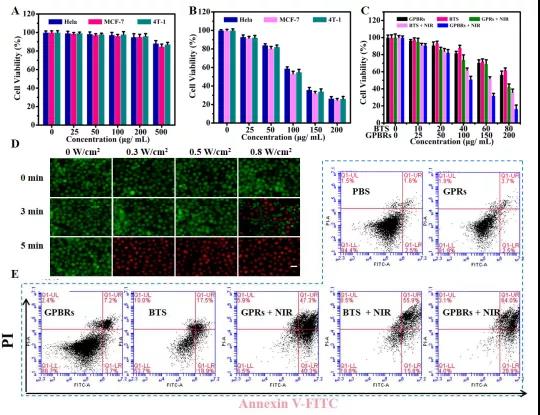
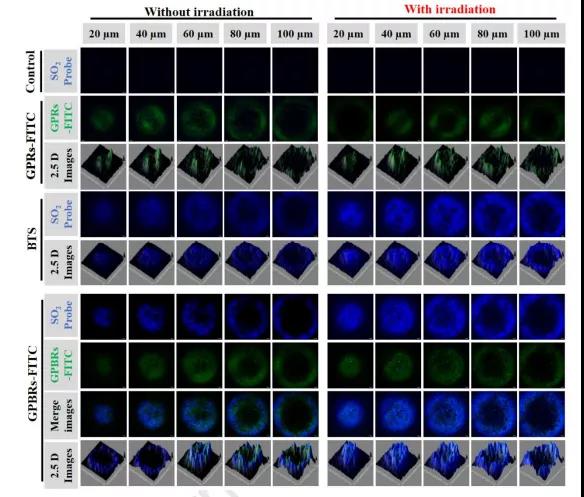
近年来,由于一氧化氮(NO)、一氧化碳(CO)、氢气(H2)和二氧化硫(SO2)等气体分子可用于诱导癌细胞死亡,因此气体癌症治疗越来越受到重视。在肿瘤组织中良好的扩散能力、通透性更强、保留(EPR)效应以及改善纳米颗粒在肿瘤部位的聚集,使得气体治疗优于化疗、放疗等现有的治疗方法。为了使气体分子更加可控,设计了气体前药和气体供体,保证治疗性气体选择性地积聚在特定区域,同时在血液中保持较低的浓度。 最近的研究表明,SO2对哺乳动物除了有毒性作用外,还具有保护作用。据报道,SO2作为治疗多种疾病的气体有很大的潜力,包括心脏缺血再灌注(I/R)损伤、炎症和癌症。为了治疗特定的疾病,所以SO2必须被准确地运送到目标组织。到目前为止,已经开发出了几种基于不同释放机制的SO2小分子前药,包括利用谷胱甘肽、pH和光诱导释放。有学者构建了紫外光敏感的SO2前药(DM),这是一种具有上转换核心和中孔壳的核壳纳米载体。还有学者提出了一种对谷胱甘肽响应的SO2前药作为纳米载体来对抗多药耐药。然而,SO2的释放仍受到体内和原位穿透深度的限制。此外谷胱甘肽的内源性刺激一旦打开就不能停止或中断。 天津大学药物科学与技术学院李楠副教授课题组合成了基于SO2前药(苯并噻唑亚磺酸盐,BTS)掺杂纳米金棒@介孔多巴胺(GNRs@PDA-BTS,GPBRs)用于外源性和内源性刺激释放SO2的纳米颗粒。该纳米平台具有三个独特的优势:(一)由于其多孔中空结构,实现了超高(~80%)的药物载荷,以及聚多巴胺上丰富的氨基基团;(二)具有较低的pH值和光热双重响应特性,可精确定位可控气体抗肿瘤治疗;(三)将外部光热治疗与内部SO2气体治疗相结合,实现了“内外通”清除浅表和深层肿瘤细胞的可能。在近红外激光照射下,金纳米棒和聚多巴胺可作为优良的加热转化剂,提高浅表癌细胞的表面温度,进一步实现低功率密度光热治疗(方案1B)。那么,升高的温度加上肿瘤固有的酸性环境,可以促进SO2的持续释放向深层/远处的组织扩散。亚硫酸盐自氧化产生大量活性氧(ROS),如自由基,增加促凋亡蛋白p53、Bax和caspase-3的表达,降低抗凋亡蛋白bcl-2的表达。综上所述,基于纳米平台首次阐明了SO2诱导细胞凋亡的体内外机制,探索了治疗深层肿瘤的前瞻方法。 基本信息 题目: SO2 prodrug doped nanorattles with extra-high drug payload for “collusion inside and outside” photothermal/pH triggered-gas therapy 期刊:Biomaterials 影响因子:10.317 PMID:32738655 作者: 药学院硕士卢强兰为论文第一作者 药学院副教授李楠为通讯作者 作者单位:天津大学 索莱宝合作产品: 产品名称 产品货号 Hoechst 33342 Reactive Oxygen Species Assay Kit ANNEXIN V- FITC/PI凋亡检测试剂盒 Lyso-Tracker Red (溶酶体红色荧光探针) 摘 要 近年来,气体治疗纳米平台蓬勃发展,成为癌症治疗的一个很有前景的领域。然而,气体产生不受控、不充分的问题以及其治疗机制尚不明确,仍是气体治疗应用于临床的一大挑战。在这里,我们探索了一种基于二氧化硫(SO2)前药掺杂纳米颗粒的气体处理方法,不仅可以抑制浅表肿瘤,还可以抑制深层肿瘤。制备了一种水溶性SO2前药苯并噻唑亚磺酸盐(BTS)掺杂的由金纳米棒核和聚多巴胺(PDA)壳(GNRs@PDA-BTS,GPBRs)组成的具有高药物载荷(~80%)铃状结构的多孔纳米胶囊。利用良好的光热转换能力以及肿瘤部位的酸性条件,可以通过光热和pH精确控制SO2气体的释放,实现“内通”气体治疗和“外通”的光热治疗。此外,我们发现细胞毒素SO2可以诱导细胞凋亡,并上调细胞内活性氧(ROS)水平,调节凋亡相关蛋白p53、bcl-2、Bax和caspase-3。这种光热/pH触发的SO2气体治疗可能为促进深层肿瘤治疗的进一步发展提供一种有效的策略。 研究内容及结果 1、GPBRs的制备与表征 由金纳米棒核、多孔聚多巴胺外壳和2个前药BTS组成的纳米颗粒(GNRs@PDA-BTS,GPBRs)的合成步骤如图1A所示。首先,通过一种简单的无核方法制造了GNRs。透射电镜(TEM)图像显示,制备的GNRs的尺寸为28×7nm(图1A)。为了制备具有大表面积的中空多孔外壳的蛋黄-壳结构,在GNRs表面引入二氧化硅作为软模板。硅胶壳的均匀厚度约为12nm(图1B)。接下来,将制备的GNRs@SiO2(GSRs)进一步涂覆聚多巴胺(图1C)。氢氟酸和氟化铵去除非晶态二氧化硅外壳(GNRs@SiO2@PDA),得到均匀的大空腔多孔外壳GNRs@PDA纳米颗粒(GPRs)(图1D)。最后GPRs装载BTS制作最终配方,我们称之为GPBRs。SEM图像显示,GPBRs具有较大表面积的多孔外壳,有利于载药(图1E和F)。我们可以观察到元素“S”在Au和N周围混合,说明药物被装载到GPBRs的空腔和多孔壳中。GPBRs的UV-vis光谱显示了500~800nm的高吸收谱,峰值在~800nm(图1G),因此我们选择了808nm的激光加热GPBRs来产生过高热。此外与GNRs@SiO2(GSRs)相比,GPBRs吸收强度在1071和800cm-1时的FT-IR光谱有所下降,证实了二氧化硅的去除。而1605cm-1、1510cm-1和1295cm-1的峰值验证了PDA(图1H)的存在。此外(111)、(200)、(220)和(311)的切面证实了面心立方金晶体结构(图1I)。GPBRs的化学成分,包括 S,Au,Si,O,N和C进一步由能量色散x射线(EDX)光谱和x射线测量光谱扫描(XPS)(图1J和K)。N 1s区域高分辨率光谱分别由三个亚峰组成(图1L),分别是:397.7eV(碳氮=R),399.5eV(R1-NH-R2)和402.3eV(R-NH2)。空心腔和GPRs的多孔壳结构进一步证实了N2吸附/解吸等温线,表现出一个IV型曲线,在P/Po 0.4-1.0范围内有一个大的磁滞回线,对应于一个大的表面积167.4m2g−1和一个相对尖锐的孔隙分布,大小集中在大约5.4纳米。测量GNRs、GSRs、GSPRs、GPRs和GPBRs的电位分别为36.1±1.3、-30.1±1.2、-15.3±0.8、-7.61±0.9和-12.4±1.7mV(图1N),证明每一步制备成功。另外,GNRs、GSRs、GSPRs、GPRs和GPBRs的流体动力直径分别为43.8nm、58.7nm、78.2nm、69.3nm和70.1nm(图1O)。GPBRs在1、3、5天后分散均匀,进一步显示了良好的稳定性(图1P)。 Figure 1 2、pH/光热双重控制SO2释放 水溶性BTS的结构如图2A所示。由于亚硫酸盐的结构,BTS在酸性环境下容易水解成SO2。而且随着温度的升高,水解速度会加快,从而控制了SO2的释放速度和释放量。为了研究GPBRs的体外光热性能,以去离子水为对照,不同浓度的GPBRs用近红外激光(808nm)照射5min(图2B)。由于采用了金纳米棒内核和聚多巴胺外壳,GPBRs的UV-vis光谱呈现出持续的红移和强度增加(图1G),表明近红外消光和光热转换性能增强。此外我们使用不同的功率密度或辐照时间来检测最终温度(图2C)。结果表明,可以通过温度的精确控制来控制二氧化硫的释放和释放速度。另外GPBRs的光热转换效率为34.6%(图2D)。通过BTS在260nm处的吸光度测定BTS偶联含量(图2F)。具有中空腔和多孔壳体的核壳结构将是一种理想的纳米载体。此外,聚多巴胺本身富含氨基-醌组。因此,GPRs表现出了79.2%的超高BTS运载效率(图2G)。为了验证光刺激和酸性环境下SO2的发射性能,我们在体外模拟了酸性(pH 5.0)和中性(pH 7.4)条件。我们可以观察到酸性条件下的相对荧光强度是中性条件下的1.8倍,说明较低的pH值有利于SO2的释放。并且照射后相对荧光强度增加,说明通过调节激光照射时间和功率密度,可以增强SO2的释放(图2H)。另外使用SO2试纸对SO2释放进行定性分析(图2I)。 Figure 2 3、细胞实验 为了评价GPBRs在不同癌细胞中的细胞毒性,我们利用Hela、4T1和MCF-7癌细胞进行标准的MTT实验。如图3A和3B所示,在无近红外(0.5W/cm2,5min)情况下,GPBRs的细胞毒性很小。然而当暴露于近红外时,我们可以在这三种癌细胞中观察到明显的剂量依赖性现象。用200µg/mL浓度的GPBRs处理后,三种细胞的细胞存活率相对较低(约20%)。此外我们通过MTT法评估了气体疗法和光热疗法的抗肿瘤效果(图3C),结果表明气体治疗和单独光热治疗效果均不理想,特别是单独使用气体疗法,即使在最高剂量下,其细胞毒性也很小。这可能是由于光热效应所产生的温度适中,从而开启了SO2的释放,与预期的一样,GPBRs+NIR组表现出气、光热协同治疗效果。然后采用活/死细胞试剂盒检测GPBRs的治疗效果。光热消融时间与功率密度的关系在图3D中为正相关。如预期的那样,所有细胞在没有照射的情况下都存活(绿色),说明纳米颗粒具有良好的生物相容性。流式细胞术揭示了光热和气体治疗细胞死亡的更多细节和机制(图3E)。4T1细胞BTS(气体单独治疗)组显示14.7%的晚期凋亡和14.7%的早期细胞凋亡,而BTS+近红外光谱组显示早期细胞凋亡和晚期凋亡分别为55.9%和15.8%,此外4T1细胞处理GPRs+近红外光谱(光照疗法单独)组表现出凋亡早期和凋亡晚期分别为40.3%和47.3%。 Figure 3 4、SO2体外深层穿透评估 为了研究近红外增强SO2对4T1肿瘤微球体的深层穿透能力,我们将其分别与GPRs-FITC、游离BTS和GPBR-FITC孵育12h,通过CLSM获取不同处理的穿透深度,并通过Image J软件进行分析(图4)。可以看到GPRs-FITC(绿色荧光)处理组无论有无近红外处理均无显著差异。在另外两组中荧光信号随着深度的增加而减少。而游离BTS(蓝色荧光)处理组的荧光强度在照射后甚至在100μm深度都有所增强。这些现象表明BTS可以实现光热增强的SO2释放,从而促进SO2向深部扩散。 Figure 4
地 址: 北京市北京经济技术开发区环科中路16号26幢3层301 联系人: 索莱宝-龚思雨 电 话: 010-50973130 传 真: Email:3193328036@qq.com
北京索莱宝科技有限公司
商家主页
文献解读|具有超高药物载荷二氧化硫前药掺杂的纳米颗粒用于光热/pH触发内外合用的气体疗法
作者:北京索莱宝科技有限公司 2020-08-31T00:00 (访问量:4609)
相关咨询
群英荟萃|索莱宝精彩亮相第十七届全国免疫学学术大会 (2025-11-14T00:00 浏览数:4728)
救命!实验室党挖到宝了!有被狠狠惊艳到!——QuEChERS前处理 (2025-11-14T00:00 浏览数:4623)
靶点星选第一期|核内参Histone H3.1 (2025-11-14T00:00 浏览数:4583)
给细胞画个“发光轮廓”:揭秘生命的第一道防线——细胞膜 (2025-11-14T00:00 浏览数:4518)
相约广州|第二届实验室试剂应用及发展交流活动 (2025-11-14T00:00 浏览数:4295)
展会介绍丨第二届实验室试剂应用及发展交流活动 (2025-11-07T00:00 浏览数:13550)
结果公示丨第六届“病理杯”微观艺术盛宴,人气佳作新鲜出炉 (2025-11-07T00:00 浏览数:8449)
展会招商丨2025年科研试剂产学研交流及展示活动火热招商中! (2025-11-07T00:00 浏览数:10455)
C2C12成肌细胞成肌管诱导分化培养基试剂盒 (2025-11-07T00:00 浏览数:9512)
动物模型诱导——D-半乳糖诱导的衰老模型 (2025-11-07T00:00 浏览数:13237)
