总结
在GSK分享的单DNA分子BAC结构中将CMV启动子驱动的转录单元以transfer-gagpol-VSVg-rev的顺序首尾1:1:1:1相连排列,但是也发现,在相同的BAC转染细胞后,不同的单克隆细胞的每个载体基因DNA拷贝数和mRNA表达水平存在差异。因此,在细胞系构建的过程中,应筛选足够数量的克隆,以获得一个mRNA表达水平理想的克隆,获得最佳的产量和感染性。将BAC结构转染宿主细胞后,根据经验能够从几十个单克隆细胞系中筛选出高产的克隆,因此GSK认为,这种包装细胞系的方法能够减少克隆之间变异。未来也可以进一步的载体改造,将其中的基因片段用改进的基因进行替换,快速利用多个片段组装或基因合成为一个BAC片段,单次的转染能简化并加速慢病毒稳定生产细胞株的构建流程,提高慢病毒载体的产量、质量和安全性。FDA和EMA也认为这种稳定生产慢病毒的细胞系平台可用于生产临床使用的慢病毒,也没有提出慢病毒载体制造工艺之外的要求。这种简单有效的生产细胞株培养技术,可广泛应用于慢病毒载体制造的产业化,并有可能在未来为更多的患者提供基因治疗药物。
瞬时转染为基础的慢病毒载体制造工艺用于临床是基因治疗领域的标准方法,但通常需要大量GMP级别的质粒DNA和转染试剂。相比较之下,构建稳定的生产细胞株更适合于大规模的慢病毒的生产,建高产细胞株的主要流程如图6所示,经过单克隆细胞筛选、扩增培养和验证,最终获得细胞活力高、生长能力强,并且表达水平、稳定性、质量情况都具有最高表现的单克隆细胞株。
图7:细胞系构建的流程
GSK利用Cytena单细胞打印机替代常规的有限稀释的方法筛选单克隆细胞,由于其温和而高效的分选原理,使得单细胞率>95%,克隆恢复率与有限稀释相当,获得大量单克隆来源的细胞,并提供分选过程中的喷嘴图片作为单克隆细胞来源的佐证,进一步加速慢病毒生产细胞株构建的工作流程,促进基因与细胞治疗的发展。

1
分割线
[1].Meng F, Chen C, Wan H, Zhou Q. [Advances of lentiviral vectors]. Zhongguo Fei Ai Za Zhi. 2014 Dec;17(12):870-6. Chinese. doi: 10.3779/j.issn.1009-3419.2014.12.09. PMID: 25539614; PMCID: PMC6000409.
[2].Ferreira MV, Cabral ET, Coroadinha AS. Progress and Perspectives in the Development of Lentiviral Vector Producer Cells. Biotechnol J. 2021 Jan;16(1):e2000017. doi: 10.1002/biot.202000017. Epub 2020 Aug 2. PMID: 32686901.
[3].Chen YH, Pallant C, Sampson CJ, Boiti A, Johnson S, Brazauskas P, Hardwicke P, Marongiu M, Marinova VM, Carmo M, Sweeney NP, Richard A, Shillings A, Archibald P, Puschmann E, Mouzon B, Grose D, Mendez-Tavio M, Chen MX, Warr SRC, Senussi T, Carter PS, Baker S, Jung C, Brugman MH, Howe SJ, Vink CA. Rapid Lentiviral Vector Producer Cell Line Generation Using a Single DNA Construct. Mol Ther Methods Clin Dev. 2020 Aug 14;19:47-57. doi: 10.1016/j.omtm.2020.08.011. PMID: 32995359; PMCID: PMC7501408.
慢病毒载体(Lentiviral vectors, LVs)是以人类免疫缺陷型病毒(HIV)为基础发展起来的基因治疗载体,最被广泛应用的慢病毒载体是基于双链RNA病毒人类免疫缺陷I型病毒(HIV-1)[1]。HIV-1型慢病毒载体系统的建立,经历了一个逐步完善的过程,其生物安全性不断提高。
LVs对分裂细胞和非分裂细胞均具有感染能力,更加安全,并可以在体内长期的表达。这一特性使LVs成为临床研究的理想选择,美国食品和药物管理局(FDA)和欧洲药物管理局(EMA)已经批准多个以慢病毒为基础的基因疗法。目前,LVs在β-地中海贫血(β-thalassemia)、镰状细胞性贫血(Sickle cell anemia)、实体瘤(Solid tumors)和COVID-19等疾病(图1)的细胞和基因治疗中得到了广泛的应用,如CAR-T细胞治疗。
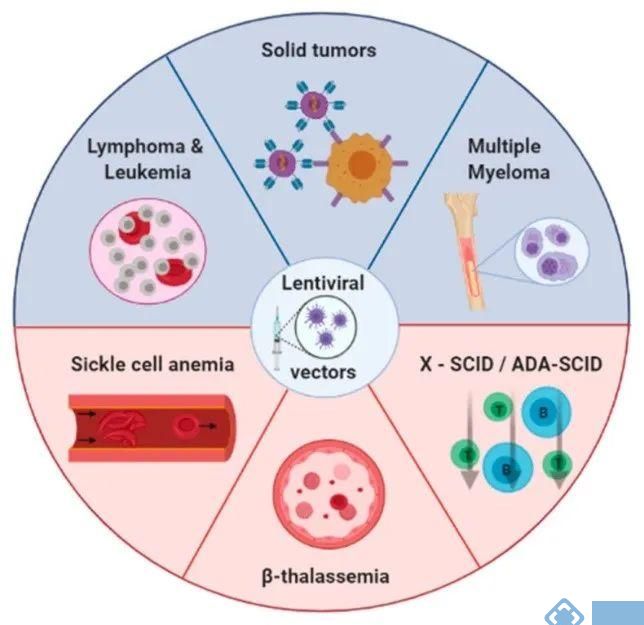
图1:使用LVs的临床试验数量最多的主要疾病[2]
临床试验需要大量功能性慢病毒颗粒,提高慢病毒的包装与生产水平可有效促进慢病毒介导的基因治疗的发展。LVs通常是通过将编码载体组分的多质粒瞬时转染到贴壁HEK293T细胞中来生产。瞬时转染的方式需要耗费很高的成本和很长的时间来获取质粒DNA,从而使生产过程极其昂贵;在放大过程中,质粒和转染试剂的残留,也会引起终产物的污染。相较于瞬时转染生产,稳定的慢病毒生产才是基因治疗的更优选择。稳定生产细胞株将其所有载体编码的DNA都稳定地整合到宿主细胞基因组中,可以降低生产成本、提高整体安全性和可重复性。
英国著名的葛兰素史克药物研究中心报告了一种通过稳定转染编码所有慢病毒载体成分的单个 DNA 结构体到 293T 细胞,快速生成稳定生产慢病毒载体的细胞系的方法。由此产生的稳定悬浮细胞系可生产出与瞬时转染一样高滴度的慢病毒,可以在一次性搅拌式生物反应器中轻松放大,并且在后续细胞培养中遗传和功能稳定。通过在慢病毒载体的上游加工过程中消除对有效瞬时转染的要求,并改用固有的可扩展悬浮细胞培养形式,他们认为这种方法将生产出比当前制造工艺更高的批量产量,并使患者能够更好地获得基于慢病毒载体的药物[3]。
载体构建
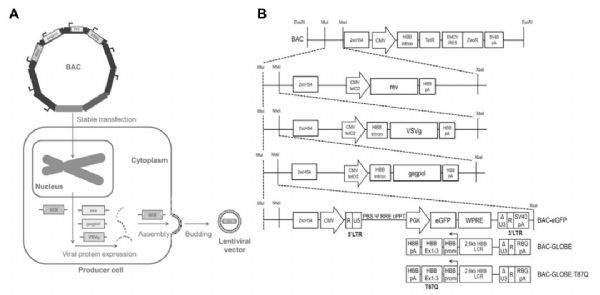
LVs生产细胞株通常是基于顺序稳定转染或将编码每个载体组分(转移质粒、包装质粒gagpol-rev和包膜质粒VSVg)的DNA转导到基因组不同位点的宿主细胞。这种策略导致细胞系开发时间长,并且至少有一个基因座可能发生遗传或转录不稳定的高风险,从而导致生产力损失。为了避免这种情况,GSK使用第三代慢病毒载体系统,载体组件由四个独立的转录单元编码,每个单元都有自己的启动子和多聚腺苷酸化信号,防止产生复制能力强的慢病毒(RCL)颗粒,一个将所有的载体成分构建成单个大DNA结构(BAC)并整合入宿主细胞(图2)。
慢病毒载体稳定生产细胞系的开发
慢病毒载体的稳定生产
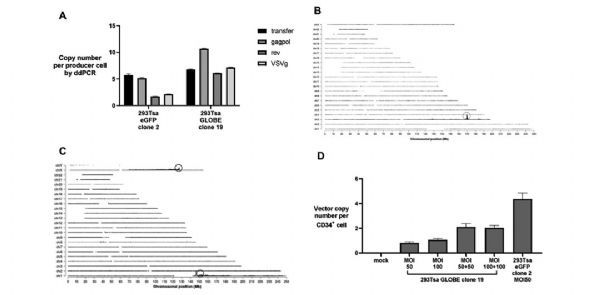
利用微滴式数字PCR (ddPCR)定量每个载体成分DNA拷贝数,每个成分的拷贝数在1到10拷贝数/细胞之间变化(图4A)。通过靶向位点扩增技术(Targeted locus amplification,TLA)对293Tsa EGFP clone 2的BAC DNA进行整合位点定位,在chr3:169,967,149-169,967,179处发现了一个整合位点(图4B),在293Tsa GLOBE clone 19中,于chrl: 146,557,007和chrX: 127,363,436处发现了两个整合位点(图4C),表明BAC DNA在随机整合到宿主细胞基因组之前发生了异位串联,转染圆形的BAC DNA质粒,宿主的DNA修复蛋白会对其进行重排,从而产生线性整合DNA。
以MOI=50或100的慢病毒转导CD34+细胞,通过qPCR检测转导细胞的载体拷贝数(VCN),重复转导使得每个细胞产生2个拷贝的VCN,表明稳定的细胞系产生的病毒载体可以感染类似难以感染的原代细胞(图4D)。
图4:293Tsa EGFP clone 2和293Tsa GLOBE clone 19
慢病毒稳定包装和瞬时转染生产对比
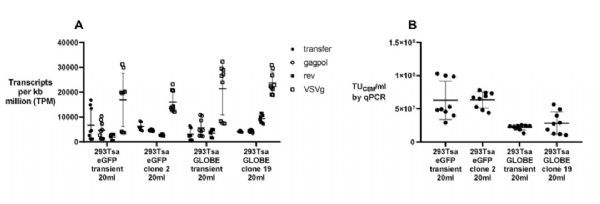
构建相同的4质粒系统瞬时转染293Tsa细胞,通过RNA测序(RNA-seq)来定量各载体组分的RNA水平。各组分的RNA瞬时表达和稳定表达之间没有显著差异,只有293Tsa GLOBE clone 19的rev表达升高(rev比瞬时表达高2.88倍,p = 0.0003);并且,稳定克隆的不同培养瓶之间每个载体组分的RNA表达水平的变异性显著低于瞬时表达(p < 0.001) (图5A)。另外,瞬时转染和稳定表达的慢病毒在病毒滴度效价方面均未观察到显著差异(图5B)。
图5:慢病毒稳定表达与瞬时转染表达对比
稳定包装生产慢病毒的功能和遗传稳定性验证
使用低温储存的12个单克隆细胞进行排序,在15ml一次性搅拌槽微生物反应器中制备慢病毒载体并检测其病毒滴度(图6A)。选取效价最高的4个克隆(clone1, 3, 9, 10)连续摇瓶培养数周来评估病毒滴度和遗传稳定性,使用选取三个时间点,在强力霉素诱导下,使用ddPCR和ELISA法对比病毒滴度,clone3, 9, 10的病毒滴度没有显著变化,clone1的滴度下降(p = 0.0011)(图6B);在相同的三个时间点,采集非诱导的细胞基因组DNA检测BAC各基因拷贝数量变化,四个克隆在遗传上都是稳定的,既没有丢失整合DNA编码的载体成分,也没有通过重复感染扩增转移载体拷贝数(VCN)(图6
地 址: 广州番禺兴南大道483号 联系人: Carrie 电 话: 020-34821111 传 真: 020-34820098 Email:biotech@applitechbio.com
广州市艾贝泰生物科技有限公司
商家主页