近几年,单细胞技术无论在发展还是在需求上均呈现“井喷之势”。因为传统研究往往是针对大量细胞分析得到的平均结果,掩盖了单个细胞的差异,无法捕捉单细胞层面更精细的变化。因此,在单细胞水平解析复杂多样的细胞图谱已经成为重要方向。尤其在癌症、免疫、发育、进化等研究方向上,揭示细胞异质性变化已成为当下热点和机遇。
目前,单细胞基因组和转录组技术已较为成熟,但蛋白层面发展非常有限。这是因为单个细胞的蛋白质一般不足200pg,且复杂程度更高,因此对质谱技术提出了更高的要求。总的来说,利用质谱进行单细胞水平蛋白质组分析主要面临着三大挑战:1)有效的将肽段传输到质谱检测器中;2)肽段序列的鉴定;3)提高检测通量。
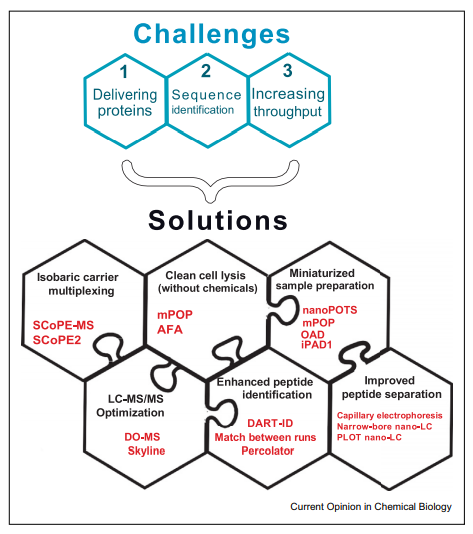
针对单细胞蛋白质组面临的挑战,来自美国东北大学的Nikolai Slavov团队自主研发了SCoPE-MS及SCoPE2技术,并在“Single-cell protein analysis by mass spectrometry”中进行了详细阐述,该技术优化了6大解决方案,再次提升蛋白质组鉴定能力,使得单细胞蛋白质组之梦咫尺可及,为细胞异质性研究的突破带来无限可能。
Solution 1
SCoPE-MS引入了一个同位素载体的概念,利用TMT标记低丰度的目标样本以及一个相对高丰度的载体样本,混合后上机检测。TMT标记使得单细胞的肽段序列和和bulk样本具体相同的质荷比,碎裂后通过报告离子进行相对定量。这种方式有三个优点:一、吸附损失会按比例主要影响载体样本,从而减少微量样本的损失;二、载体蛋白组可以提供肽段碎片,从而可以提高肽段序列鉴定能力;三、TMT可以同时检测多个样本,提高检测通量。
值得注意的是,由于载体只能减少损失和提高肽段序列的鉴定,而不能放大或提高信号离子的强度。因此,最重要的是将更多的肽段传输到质谱中,才能支撑起更可靠的定量分析。
Solution 2
常规的细胞裂解会使用去垢剂或其他一些化学试剂,不去除干净会影响蛋白酶解和质谱分析。但去除化学试剂这个过程会损失样本的同时,还会增加实验流程的复杂性。自适应聚焦声波(AFA)是一个天然的提取蛋白的方法,不会引入质谱不兼容的试剂,当然,要注意的是其要求样本体积在10ul以上,且需较高的自动化设备成本。
Solution 3
前处理第二代方法——迷你蛋白质组学样本准备仪(mPOP),利用的是冷冻-热循环系统将蛋白传输至质谱系统,并将样本体积减少了十倍且成本低廉。样本体积的减少降低了试剂的使用量,也减小了试剂与样本接触的表面积,从而减少了样本损失的可能性。
更进一步的,仅需要几百纳升的nanoPOTS、OAD,以及iPAD1的方法被发明了。SCoPE-MS就是采用了nanoPOTS。此时面临的难点在于纳升级别的样本进样需要手动操作。因此,想要充分利用微型细胞裂解和样品制备需要进一步微型化所有其他分析步骤,包括高效且自动地将小样品装载到色谱柱上。
Solution 4
LC-MS/MS参数的优化可以提高鉴定到的肽段数以及定量的准确性,尤其是对于单细胞组学这样的极微量的样本,任何一点污染物或是离子传输过程的损失都会严重损害数据质量。作者团队开发了优化LC-MS/MS参数的模块化和交互式工具DO-MS。DO-MS通过对肽段分离和扫描,到谱图匹配等各个阶段的数据进行交互式可视化来诊断分析中的问题,是SCoPE2的一个主要组成部分。其一大优势在于可以显示肽段洗脱时距离峰值的时间偏移以及肽段进入二级质谱分析的时间。这些数据可以使得我们可以合理的纠正系统性误差,选择最佳的质谱参数,从而最大化进入串联质谱分析的肽的比例或者能够尽量使提取的位置接近肽的峰值。
Solution 5
肽段的丰度可以基于单个质荷比的峰计算,但是序列的确定则需要多个片段离子。因此低丰度的肽段容易定量,但序列的鉴定却很难。为了克服这个困难,通常会用到所有特征性的信息对数据进行过滤,比如肽段的保留时间和离子淌度。但数据过滤的方法也是无法改善假阳性率的,于是研究团队将贝叶斯框架和保留时间结合在一起,开发了一种数据驱动的校准保留时间的方法(DART-ID)。该方法在FDR设定为1%的条件下,将识别到的肽段的数量提升了50%。
Solution 6 优化质谱参数,提高肽段的分离度
尖锐的洗脱峰和低流速可以尽可能多的将肽段传输至质谱检测器,这可以通过毛细管电泳、高灵敏度的多为色谱策略,以及使用整体的纳米毛细管色谱柱,PLOT色谱柱、小孔径的色谱柱,还有降低流速等实现。
中科新生命
单细胞蛋白质组技术使得蛋白质组学进入了一个极微量样本的时代,可以应用于稀有细胞、处于不同分化阶段的细胞或诱导分化的细胞分析,对于组织亚结构研究、胚胎发育、肿瘤异质性、CTC细胞、干细胞分化和神经研究等提供重要的生物学意义。中科新生命紧跟技术前沿,即将推出单细胞蛋白质组学服务,敬请期待!
