肿瘤异质性是癌症进展和治疗抵抗的主要驱动因素之一。据推测,癌细胞亚群之间的合作对于维持异质性和促进肿瘤进展至关重要。然而,这种合作如何发生仍然难以捉摸。
细胞外囊泡(EVs)是细胞间通讯的中心介质。癌症EVs具有很多功能,如促进癌症相关成纤维细胞的分化,增强血管生成,调节抗肿瘤免疫应答,建立转移前生态位并赋予非转移性癌细胞转移等特性。然而,具有不同表型和肿瘤形成能力的癌细胞亚群之间EVs的交换与交流的问题尚未得到解决。
2022年1月来自葡萄牙波尔图大学的研究团队在Gut(IF=23.059)上发表了题为“Extracellular Vesicles from Pancreatic Cancer Stem Cells Lead an Intratumor Communication Network (EVNet) to fuel tumour progression”的文章,首次揭示了由胰腺癌干细胞(CSC)细胞外囊泡领导的有组织的通信网络,并展示了其在肿瘤生物学中的重要性。再通过蛋白质组学发现CSC中特异性表达的agrin,通过agrin/LRP-4/YAP通路影响肿瘤进展,并证明了agrin可作为胰腺癌治疗干预的潜在新靶点,也可用于预测胰腺癌预后。

研究材料
人胰腺癌细胞;胰腺导管腺癌原位模型;患者衍生的异种移植物模型;基因工程小鼠模型;PDAC患者的血清样本
技术路线
· 步骤1:构建荧光标记EVs的克隆,研究细胞亚群之间EVs的流动;
· 步骤2:改变微环境,研究EVNet的变化;
· 步骤3:构建动物模型,抑制EVs形成,研究破坏EVNet对肿瘤进展的影响;
· 步骤4:构建模型,比较CSC和NSCC分泌的EVs对肿瘤进展的影响;
· 步骤5:通过蛋白质组学研究CSC EVs影响肿瘤进展的原因;
· 步骤6:验证agrin可作为胰腺癌治疗的新靶点;
· 步骤7:发现并验证循环agrin阳性EVs是疾病进展的预后标志物。
研究结果
1. 细胞外囊泡在癌细胞亚群之间自发流动
首先,研究人员在人胰腺癌细胞中建立了四种不同荧光标记EVs的稳定克隆,又基于细胞表面标志物的表达,从每种克隆中分别分选出一种特定的细胞亚群,两种是以胰腺癌干细胞(CSC,与PADC的不良预后相关)为特征的罕见亚群,CD133+细胞和CD24+CD44+细胞;另外两种是占据大多数的非干细胞(NSCC)亚群,CD24−CD44+细胞和4N (CD133−CD24−CD44−EpCAM−)细胞。将这四种细胞亚群混合培养,通过共聚焦成像分析研究EVs在细胞亚群之间的流动。研究发现,69.56%±11.92%的细胞对其他亚群的EVs呈阳性,表明癌症EVs在它们之间自发流动,且流动方向以干细胞(CSC)到非干细胞(NSCC)为主,并排除了分泌的EVs数量、降解速率或细胞亚群的内吞能力的影响。综上,胰腺癌细胞亚群通过细胞外囊泡的自发流动,构建了一个有组织的细胞间通讯网络(EVNet)。
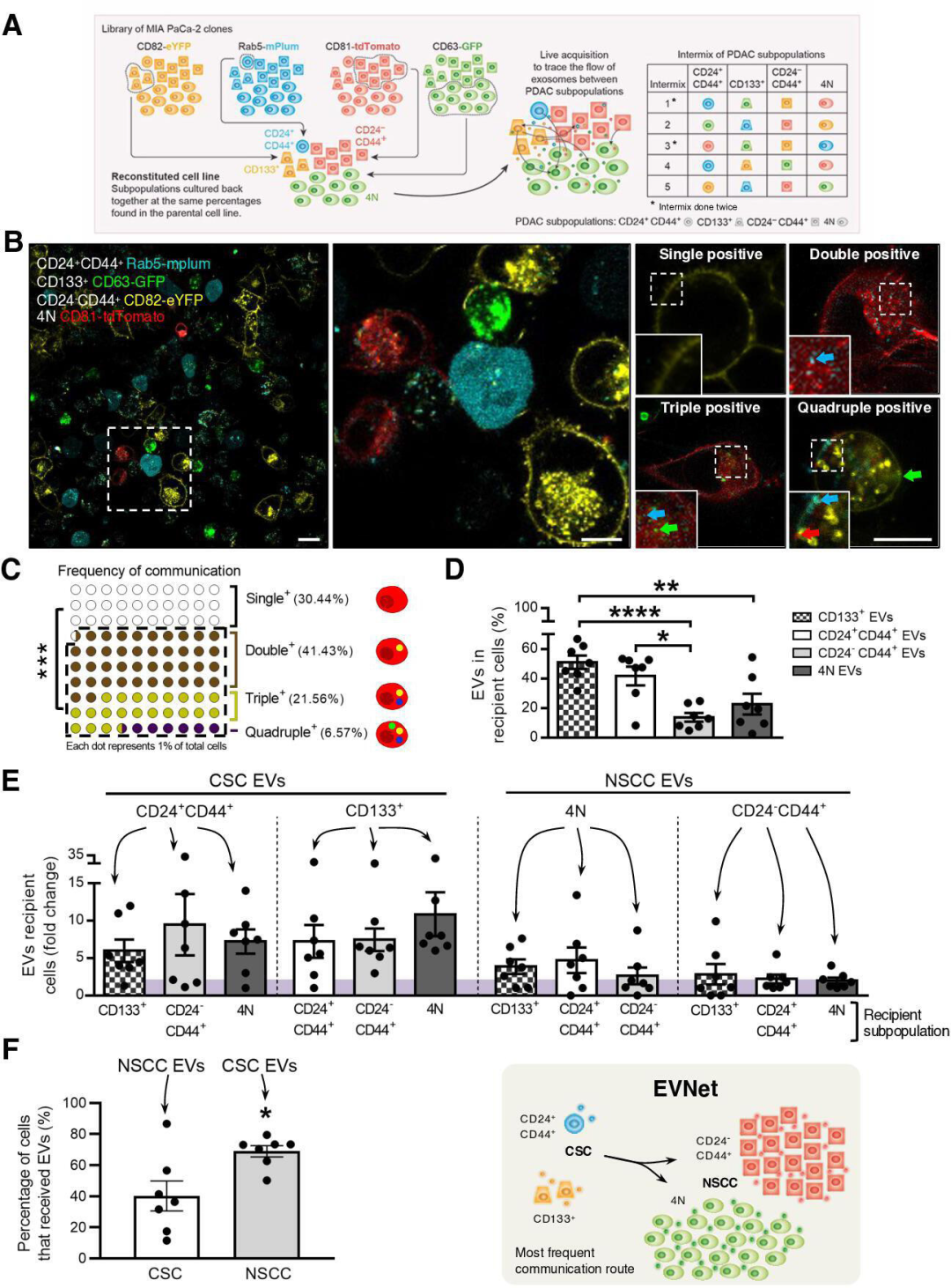
图1 PDAC癌细胞亚群之间EVs的流动
2. EVNet有助于癌细胞适应微环境
接下来,研究人员探讨了改变微环境的情况下EVNet是否受到影响。结果发现,缺氧使得细胞间的通讯频率显著增加,EVs流动方向仍以 (CSC)到(NSCC)为主。而化疗引起EVs流动方向改变,非干细胞亚群之间的通讯频率显著增加。这表明EVNet是具有可塑性的,在面对微环境的挑战时,会改变通讯速度甚至路线。
Rab27a参与细胞外囊泡的形成,敲除Rab27a后,细胞外囊泡分泌减少,缺氧和化疗让胰腺癌细胞死亡比例显著升高。因此,细胞外囊泡通讯有助于癌细胞适应微环境变化。
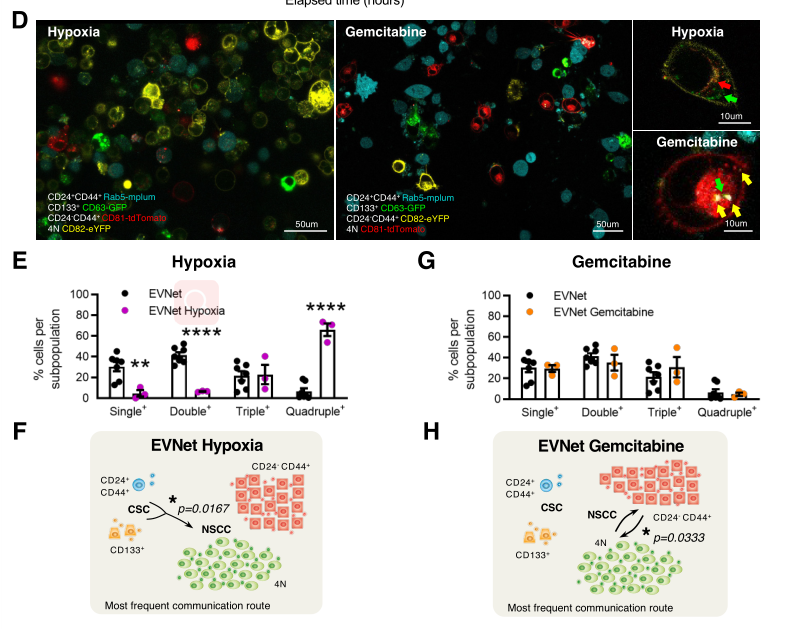
图2 微环境改变对EVNet的影响
3. 破坏EVNet会阻碍肿瘤生长
为了进一步研究EVNet的生物学作用,研究人员构建了Rab27a功能缺失型胰腺癌鼠模型,发现通过多四环素治疗的小鼠肿瘤生长减缓,肝脏大转移数量显著减少,但组织学上没有差异。接下来,用Rab27a的特异性小分子抑制剂Nexinhib20处理两种动物模型(KPC、PDXs),来抑制EVs的分泌。结果显示Nexinhib20处理后,KPC存活率显著提高,PDXs肿瘤生长减缓。综合表明Rab27a敲低会损害EVs介导的通讯,从而阻止癌症的进展。
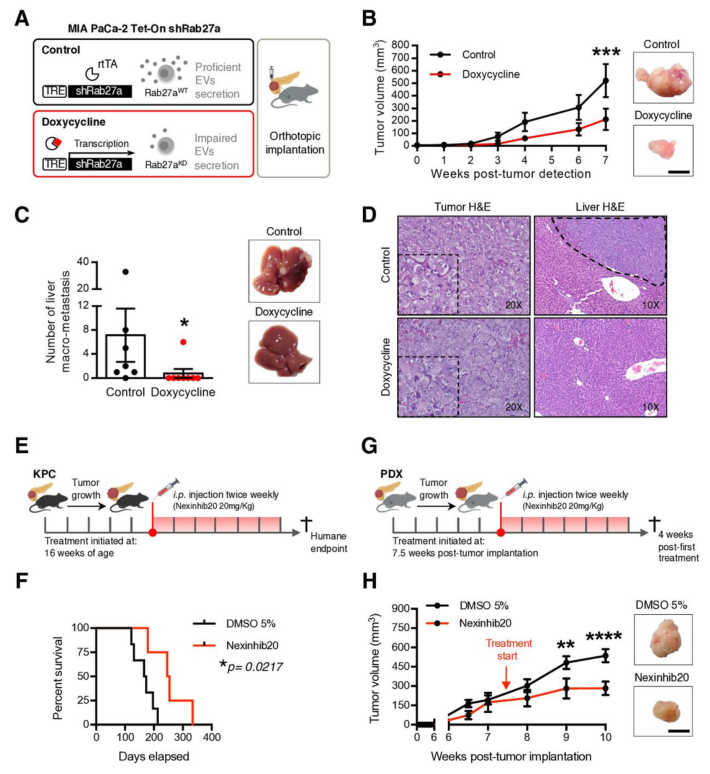
图3 EVNet对肿瘤生长的影响
4. CSC分泌的 EVs是影响PDAC进展的原因
由于EVNet中最常见的通讯路径是从CSC到NSCC,故特异性地去抑制CSC的EVs的通讯作用,从而研究其在生物学中的作用。首先从Rab27a敲低组和对照组中分别分离出CSC和NSCC细胞亚群,交叉混合后再原位移植到小鼠中,构建Rab27a敲低的CSC小鼠模型和NSCC小鼠模型。研究发现,Rab27a敲低的CSC小鼠模型中,多四环素喂养的小鼠肿瘤生长缓慢,重量显著降低;而Rab27a敲低的NSCC小鼠模型中,无显著变化。表明敲低CSC中的Rab27a,抑制其通讯能力,才是影响肿瘤生长的原因。
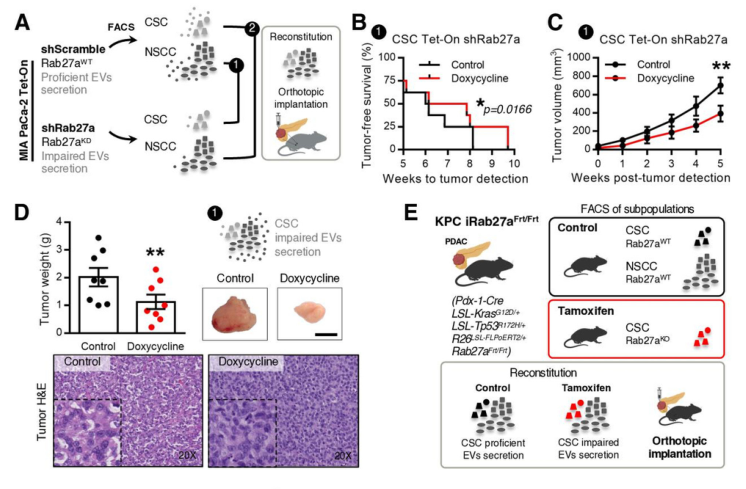
图4 CSC和NSCC通讯功能差异比较
5. CSC EVs具有独特的蛋白质组成并且富含agrin,促进肿瘤进展
为了找到CSC EVs如此特别的原因,研究人员采用labelfree蛋白质组学对四种人PDAC细胞系的癌细胞亚群及其分泌的EVs分别进行检测。通过一系列生物信息学比较分析细胞和外泌体,CSC和NSCC之间的蛋白表达及功能差异,发现CSC EVs和NSCC EVs的蛋白质组成有非常大的差异,仅在CSC EVs中检测到的大量蛋白质与PDAC发生发展过程密切相关,例如轴突导向通路,其中agrin是最富集的蛋白质之一。
在肝癌中,agrin通过与LRP-4受体结合激活YAP转录因子来促进肝癌发生。研究人员在胰腺癌细胞中也验证了此通路的存在,证明了CSC EVs中的agrin促进YAP活化,促进癌细胞的增殖和存活率。
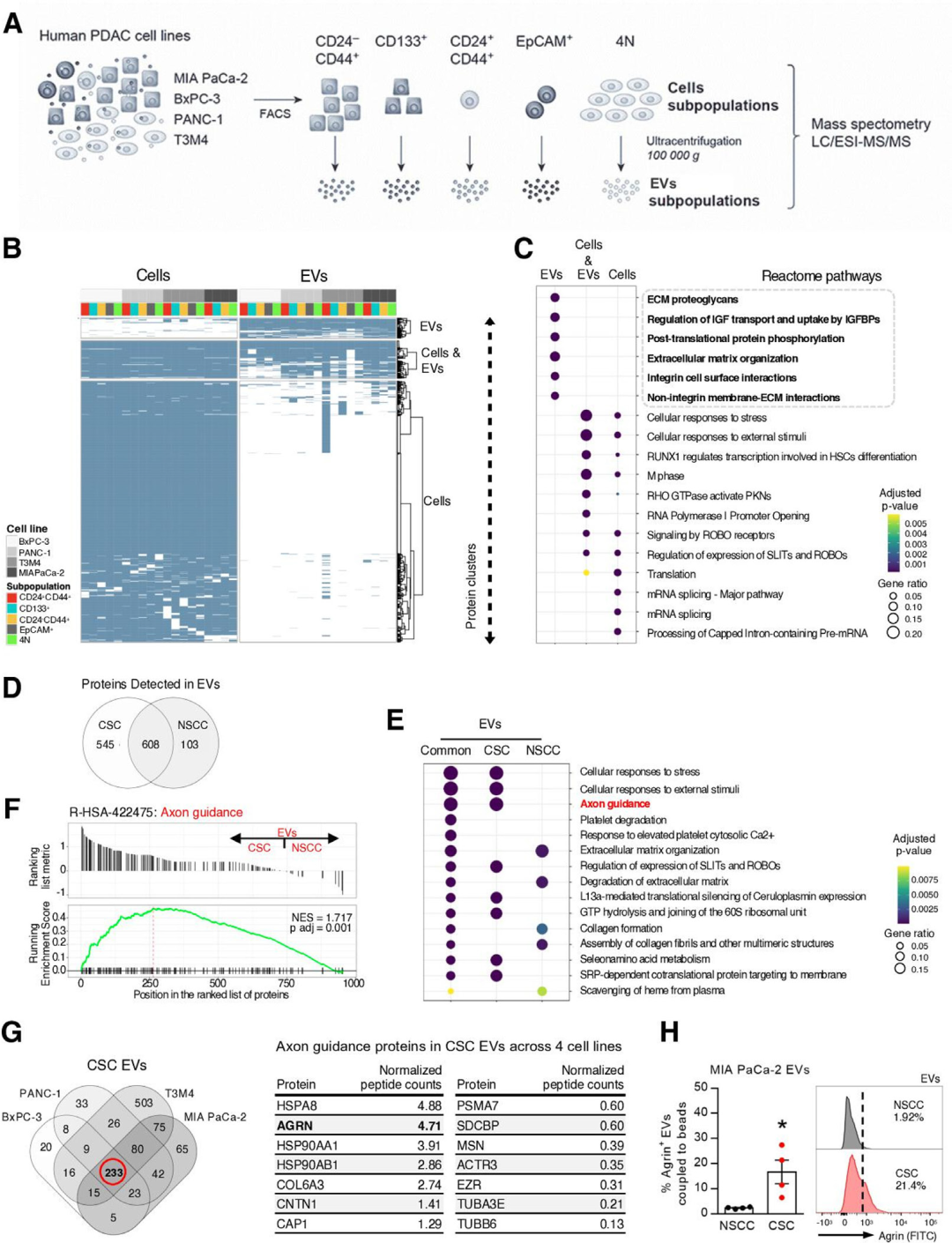
图5 CSC和NSCC EVs蛋白质表达及功能比较
6. Agrin是PDAC中CSC的潜在治疗靶点
上文已经证明了敲低Rab27a来抑制CSC中EVs的分泌可以抑制肿瘤生长,接下来,研究人员又试图评估CSC EVs中特异性表达的agrin下调是否会对疾病进展产生影响。先从agrin敲低和对照组的细胞中分离出CSC和NSCC,再交叉混合移植到小鼠中,研究发现CSC中agrin下调会导致肿瘤生长减慢,肿瘤体积减小。在构建的agrin敲低的KPC模型(KPAC)中,与KPC小鼠相比,显示出延迟的疾病进展,同时YAP表达显著下调。以上实验证明了agrin是胰腺癌治疗干预的新靶点。
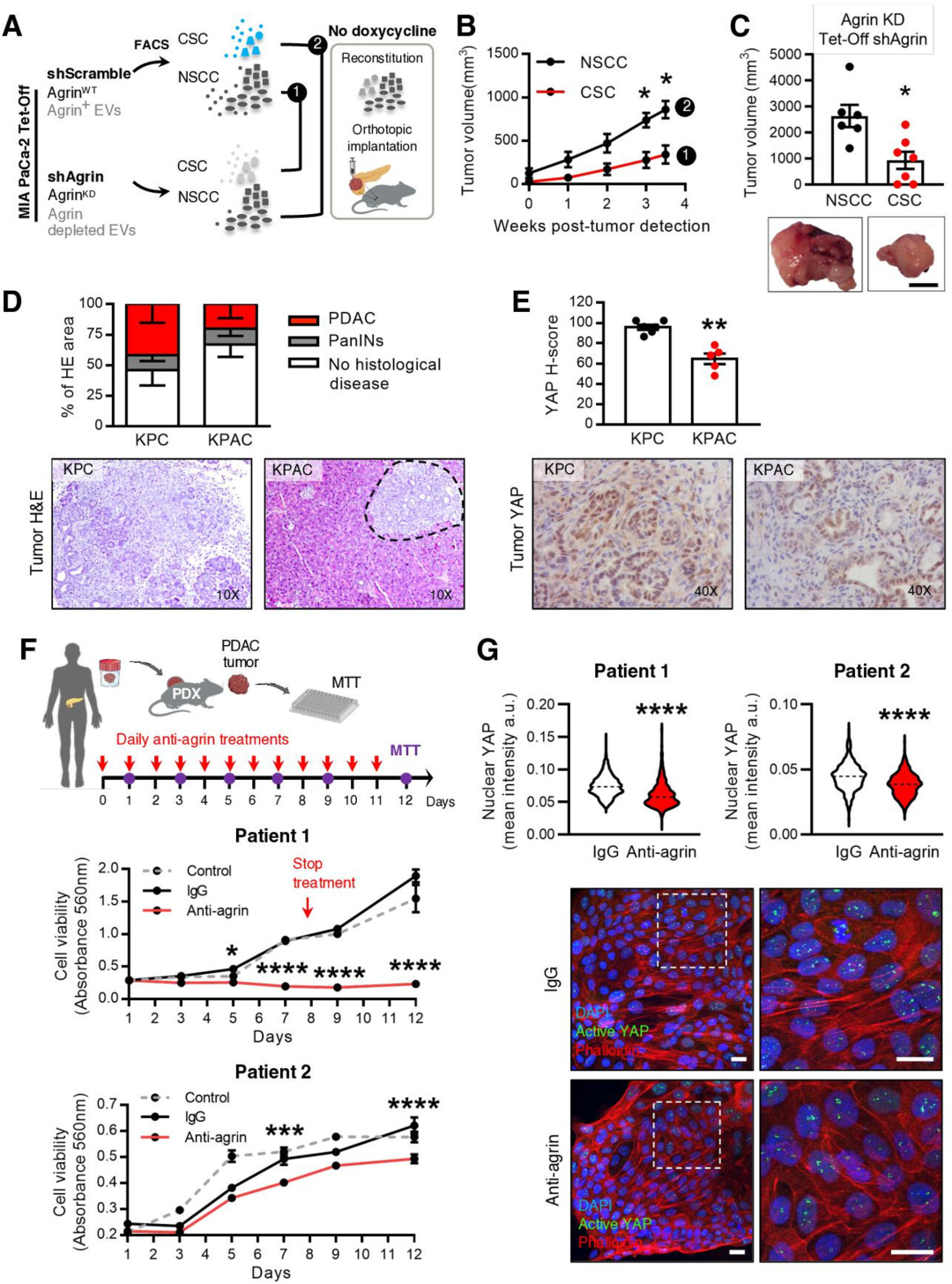
图6 阻断agrin的表达对疾病进展的影响
7. 循环agrin阳性EVs是疾病进展的预后标志物
最后,研究人员收集了44名胰腺癌患者的110例血液样本,通过成像流式细胞术鉴定EV中agrin的表达,证明了cAGRN+EV的百分比与肿瘤负荷呈正比;其次发现了cAGRN+EVs和cCD133+EVs(来源于CSC)的百分比之间有显著的相关性,进一步证明了cAGRN+EVs的来源;最重要的是,在没有手术的患者中,cAGRN+EVs每增加1%,使疾病进展的风险增加2.94倍。
又通过受试者特征曲线(ROC)分析研究发现循环agrin阳性EVs可作为未接受手术的患者疾病进展的特异性和敏感性的生物标志物,与cCD133+EVs组合会提高预测疾病进展的准确性。
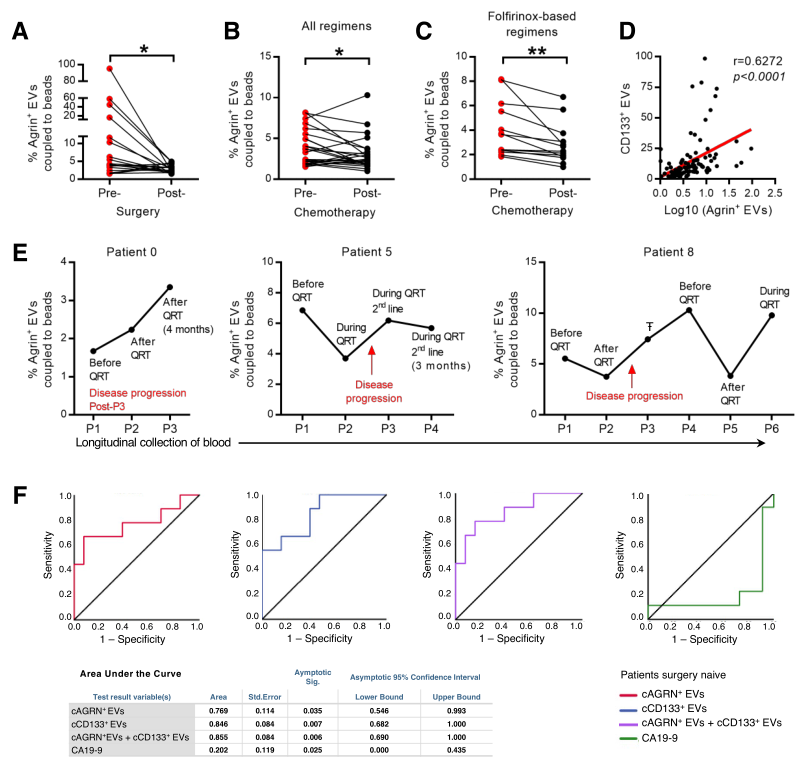
图7 疾病进程中循环agrin阳性EVs的变化
小编小结
肿瘤是不同癌细胞亚群组成的复杂实体。癌细胞亚群之间会通过EVs进行通讯交流,且这种通信对于癌细胞克服微环境变化和茁壮成长至关重要。本文的工作表明,胰腺癌细胞亚群通过富含agrin的CSC EVs建立了一个有组织的,具有可塑性的通信网络EVNet。同时发现了agrin可作为胰腺癌治疗干预的潜在新靶点,并在PDAC临床样本中,证实了cAGRN+EV是疾病进展的预后生物标志物,具有深远的临床意义。
中科优品推荐
【中科新生命】提供外泌体“提取-表征-组学分析(蛋白质组、磷酸化修饰组、脂质组)-数据挖掘”全流程服务,免去多方沟通烦恼。全程高质量保证,为您的课题研究保驾护航!